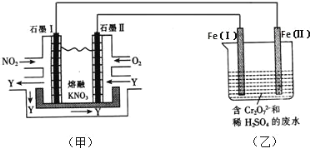
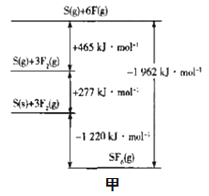
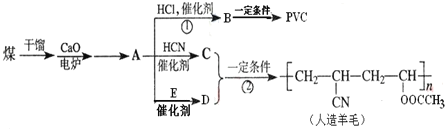
题目内容
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄血盐的工艺如图:

回答下列问题:
(1)步骤Ⅰ制备的Ca2Fe(CN)6易溶于水吗?__(填“易溶”或“不易溶”)。
(2)步骤Ⅲ的化学方程式为__。
(3)步骤Ⅴ所用的试剂X是__(填化学式)。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
已知:HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;溶液中H2CO3、HCO3-、CO32-的存在与溶液pH的关系如图所示:

①HCN的电子式为__。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。第一步控制强碱性的主要目的是__,第二步反应的离子方程式为__。
(5)已知蓝色染料普鲁士蓝的合成方法如图:

用硫酸亚铁碱性试纸可以检验食品中是否含有CN-,方案如图:
![]()
若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请用离子方程式解释检测时试纸变蓝的原因:__。
【答案】易溶 Ca2Fe(CN)6+2KCl=K2CaFe(CN)6↓+CaCl2 K2CO3 ![]() HCN有剧毒,防止生成HCN污染环境 2OCN-+3ClO-+H2O=N2↑+ 3Cl-+2HCO3- 7Fe2++18HCN+14OH-+O2= Fe4[Fe(CN)6]3↓+16H2O
HCN有剧毒,防止生成HCN污染环境 2OCN-+3ClO-+H2O=N2↑+ 3Cl-+2HCO3- 7Fe2++18HCN+14OH-+O2= Fe4[Fe(CN)6]3↓+16H2O
【解析】
(1)根据框图可知,步骤Ⅰ制备的Ca2Fe(CN)6,经过步骤II过滤得到硫酸钙和Ca2Fe(CN)6,硫酸钙属于微溶物,所以Ca2Fe(CN)6易溶于水,故答案:易溶;
(2)由步骤Ⅰ发生的反应为:6HCN+3Ca(OH)2+FeSO4=Ca2Fe(CN)6+CaSO4↓+6H2O,经过步骤II过滤得到硫酸钙和Ca2Fe(CN)6,步骤Ⅲ是往亚铁氰化钙中加入KCl,发生反应生成K2CaFe(CN)6和CaCl2,其的化学方程式为Ca2Fe(CN)6+2KCl= K2CaFe(CN)6+CaCl2,故答案:Ca2Fe(CN)6+2KCl= K2CaFe(CN)6+CaCl2;
(3)步骤Ⅴ为脱钙处理,要求所加试剂能够除掉钙离子又不能增加新杂质,所以要选择的试剂X可为K2CO3,故答案:K2CO3;
(4)①HCN属于共价化合物,通过共用电子对形成的化合物,所以电子式为![]() ;
;
②因为HCN有剧毒属于弱酸,为了防止CN-在溶液中水解生成HCN,所以要控制溶液为碱性。处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。起反应的方程式为:2OCN-+3ClO-+H2O=N2↑+ 3Cl-+2HCO3-,故答案:HCN有剧毒,防止生成HCN污染环境;2OCN-+3ClO-+H2O=N2↑+ 3Cl-+2HCO3-;
(5)因为[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+4Fe3+=Fe4[Fe(CN)6]3↓,基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-,同时Fe2+被空气中的氧气氧化生成Fe3+,Fe3+与[Fe(CN)6]4-反应生成蓝色沉淀,而使试纸显蓝色,故答案:7Fe2++18HCN+14OH-+O2=Fe4[Fe(CN)6]3↓+16H2O。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) ___________。
③向NaCN溶液通入少量CO2反应的化学方程式是_____________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____________;此时c(HCN)/c(CN-)=____________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是___________________________。
(3)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol·L-1 Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_____________mol·L-1。