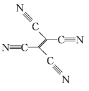
题目内容
【题目】已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是
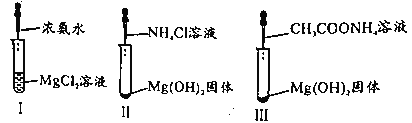
A.I中现象说明NH3·H2O碱性强于Mg(OH)2
B.II中总反应为2H++Mg(OH)2=Mg2++2H2O
C.实验II、III研究NH4+对Mg(OH)2溶解的作用原理
D.III中CH3COONH4浓度越小,越有利于沉淀的溶解
【答案】C
【解析】
A项、NH3·H2O为弱碱,Mg(OH)2为中强碱,NH3·H2O碱性弱于Mg(OH)2,故A正确;
B项、Mg(OH)2能够溶于呈酸性的氯化铵溶液和呈中性的醋酸铵溶液,说明NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动,II中总反应为2NH4++Mg(OH)2=Mg2++2NH3·H2O,故B错误;
C项、实验II、III中Mg(OH)2能够溶于呈酸性的氯化铵溶液和呈中性的醋酸铵溶液,说明Mg(OH)2溶解不是与氢离子发生反应,反应原理是NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动,导致Mg(OH)2溶解,故C正确;
D项、CH3COONH4溶液浓度越大,溶液中铵根离子浓度越大,越有利于Mg(OH)2沉淀的溶解,故D错误;
故选C。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目