题目内容
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示。已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物物的沸点如下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
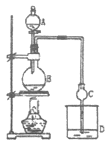
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液,经分液漏斗边滴加醋酸、边加热。
请回答:
(1)反应混合物的配制:圆底烧烧瓶中先加入___,再逐滴加入___,边加边振荡,___后,再加入醋酸。
(2)反应中加入的乙醇是过量的,其目的是___;浓硫酸的作用:①___;②___。
(3)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为___。
(4)加热除了加快反应速率外还有一个重要的目的:___。
(5)在装置中,球形干燥管主要起到两个作用:一是起冷凝作用,二是:___。
(6)试管中盛放的是饱和碳酸钠溶液,它的作用是___(选填编号)。
A.中和乙酸和乙醇 B.吸收乙酸并溶解乙醇
C.降低乙酸乙酯的溶解度,有利于析出 D.加速乙酸乙酯的生成,提高其产率
(7)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___;再加入___(此空从下列选项中选择),目的是___,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.碱石灰 B.无水硫酸钠 C.生石灰
【答案】乙醇 浓硫酸 冷却 有利于酯化反应正向进行 吸水 催化 CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O 使乙酸乙酯挥发 防倒吸 BC 乙醇 B 除去少量的水
CH3CO18OCH2CH3+H2O 使乙酸乙酯挥发 防倒吸 BC 乙醇 B 除去少量的水
【解析】
酯化反应的原理是:酸脱羟基醇脱氢生成酯和水;浓硫酸做催化剂,体现催化性和吸水性;除杂时需要饱和碳酸钠,后续还需要试剂除水。
(1)稀释浓硫酸的操作是酸入水,故先加乙醇,再缓慢加浓硫酸,放出大量热,待冷却后,加入醋酸;
故答案为:乙醇、浓硫酸;冷却;
(2)反应中加入过量的乙醇,有利于酯化反应正向进行;浓硫酸在酯化反应中做催化剂,具有催化性,还徐寿水使反应正向进行;
故答案为:有利于酯化反应正向进行;催化;吸水;
(3)酯化反应是,酸脱羟基醇脱氢,故反应方程式为:CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O;
CH3CO18OCH2CH3+H2O;
(4)加热除了可以加快反应速率,还能使产物挥发,平衡正向进行;
(5)在装置中,球形干燥管主要起到两个作用:一是起冷凝作用,干燥管在搜集装置上,还可以防倒吸;
(6)在酯化反应中,饱和碳酸钠溶液可以吸收乙酸并溶解乙醇;降低乙酸乙酯的溶解度,有利于析出,提高产率;
故答案为:BC;
(7)用氯化钙除去少量乙醇,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物,不能选择碱石灰和生石灰等固体干燥剂,以防乙酸乙酯在酸性或碱性条件下水解;
故答案为:乙醇;B;除去少量的水。

【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式______
(3)某同学取步骤③所得溶液于试管中,滴加足量盐酸、BaCl2溶液产生白色沉淀,他认为通过测定产生的白色沉淀的质量即可求出实验所用Na2CS3的量,你是否同意他的观点并说明理由______。
实验2:测定Na2CS3溶液的浓度

按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(4)盛放无水CaCl2的仪器的名称是______,B中发生反应的离子方程式是______。
(5)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是______。
(6)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为______。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值______(填“偏高”、“偏低”或“无影响”)。
【题目】水煤气变换[CO(g)+H2O(g)![]() CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。

该历程中决速步骤的化学方程式为__(方程式两边若有相同物料不用约简)。水煤气变换反应的热化学方程式为__。
(2)t1℃时,密闭容器中,通入一定量的CO和H2O,发生水煤气变换反应,容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为__。
②5~6min时间段内,平衡移动方向为__(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是__(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度__c1(填“>”“<”或“=”)。
(3)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:

①该反应是__(填“吸热”或“放热”)反应。
②若T1时水煤气变换反应的平衡常数等于0.5,则T1时FeO(s)+H2(g)![]() Fe(s)+H2O(g)的平衡常数为__。
Fe(s)+H2O(g)的平衡常数为__。
(4)水煤气可做燃料电池的燃料。一种熔融碳酸盐燃料电池的工作原理如图所示。电极A上H2参与的电极反应为__。假设催化炉产生的CO与H2物质的量之比为1︰2。电极A处产生的CO2有部分参与循环利用,其利用率为__。

【题目】(1)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和减去反应中形成新化学键的键能之和。下面列举了一些化学键的键能数据,供计算使用。
化学键 | Si—O | Si—Cl | H-H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
已知:1mol晶体硅含有2molSi-Si键。工业上可以通过下列反应制取高纯硅:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),则该反应的反应热(ΔH)为______。
(2)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
①有机物M经过太阳光光照可转化成N,转化过程如下:
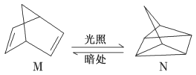 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M的化学式为_________________,M、N相比,较稳定的是____________。(填M或N)
②已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a____________238.6(填“>”、“<”或“=”)。
③使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________。
④火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子时放出的热量为_______。
(3)已知:
①H2O(g)=H2O(l) △H1=—Q1kJ/mol
②CH3OH(g)=CH3OH(l) △H2=—Q2kJ/mol
③2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=—Q3kJ/mol(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为______kJ。