题目内容
15.某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布式为(n-1)dn+6ns1,回答下列问题.(1)元素B、C、D的第一电离能由大到小的排列顺序为N>O>S.(用元素符号表示)
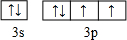
(2)D元素原子的最外层电子排布图为
(3)该配位化合物的化学式为[Cu(NH3)4]SO4•H2O,配体的中心原子的杂化方式为取sp3.
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,两种化合物可以任意比互溶,解释其主要原因为H2O与H2O2分子之间存在氢键.
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为H-N=N-H,分子中含有3个σ键,1个π键.
分析 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,据此解答.
解答 解:某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O.
(1)同主族自上而下第一电离能减小,故O元素第一电离能大于S元素,O与N元素同周期,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于O元素,故第一电离能由大到小的排列顺序为:N>O>S,
故答案为:N>O>S;
(2)D为S元素,其原子的最外层电子排布图为  ,
,
故答案为: ;
;
(3)由上述分析可知,该配位化合物的化学式为:[Cu(NH3)4]SO4•H2O,配体为NH3,N原子价层电子对数=3+$\frac{5-1×3}{2}$=4,N原子采取sp3杂化,
故答案为:[Cu(NH3)4]SO4•H2O;sp3;
(4)O元素可与H元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,则为H2O、H2O2,两种化合物可任意比互溶,其主要原因为:H2O与H2O2分子之间存在氢键,
故答案为:H2O与H2O2分子之间存在氢键;
(5)H元素与N元素可形成分子式为N2H2的化合物,该化合物的分子具有平面结构,N原子之间形成N=N双键,N原子与H原子之间形成N-H键,其结构式为H-N=N-H,分子中含有3个σ键,1个π键,
故答案为:H-N=N-H;3;1.
点评 本题是对物质结构与性质的考查,涉及元素化合物推断、电离能、核外电子排布、微粒结构与性质、杂化轨道、化学键等,关键是根据配位化合物为深蓝色晶体进行推断,难度中等.

| A. | 冰的密度比水小 | B. | H2O的分解温度比H2S高得多 | ||
| C. | 液态氟化氢中有三聚氟化氢(HF) | D. | NH3的沸点比PH3高 |
 如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( ) | M | N | P | |
| A | Zn | Cu | 稀H2SO4溶液 |
| B | Cu | Fe | 稀HCl溶液 |
| C | Ag | Zn | AgNO3溶液 |
| D | Zn | Fe | Fe(NO3)3溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Z | B. | A-Z | C. | Z-n | D. | Z+n |

| A. | 图Ⅰ研究的是t0时升高温度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 | |
| C. | 图Ⅲ研究的是压强对化学平衡的影响,且乙压强大于甲 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
| A. | Na2O2 | B. | KOH | C. | CaCl2 | D. | CO2 |
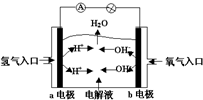
| A. | a电极是负极,电极反应为:H2-2e-═2H+ | |
| B. | b电极是正极,电极反应为:4OH-+4e-═2H2O+O2↑ | |
| C. | 电子从a极流向电流表、小灯泡、b极、通过电解质溶液形成闭合回路 | |
| D. | 电解质溶液中OH-向a极移动 |
| A. | S2-+2H2O?H2S+2OH- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
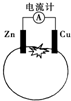
| A. | 一段时间后,锌片质量会变少 | B. | 铜电极附近会出现蓝色 | ||
| C. | 电流由铜通过导线流向锌 | D. | 锌电极是该电池的负极 |