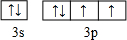
题目内容
7.如图为碱性氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )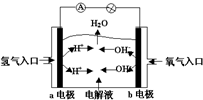
| A. | a电极是负极,电极反应为:H2-2e-═2H+ | |
| B. | b电极是正极,电极反应为:4OH-+4e-═2H2O+O2↑ | |
| C. | 电子从a极流向电流表、小灯泡、b极、通过电解质溶液形成闭合回路 | |
| D. | 电解质溶液中OH-向a极移动 |
分析 氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;当电解质溶液是氢氧化钾时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子生成氢氧根离子.
解答 解:A.燃料电池中,通入燃料氢气的电极a是负极,电极反应为:2OH-+H2-2e-═2H2O,故A错误;
B.b电极为正极,正极上得电子发生还原反应,电极反应式为O2+4e-+2H2O═4OH-,故B错误;
C.电子只能在外电路移动,而电解质溶液中是离子的定向移动,故C错误;
D.氢氧燃料电池中,电解质中的阴离子移向负极a电极,故D正确;
故选D.
点评 本题考查了燃料电池,要注意的是:虽然燃料相同,但电解质溶液不同时,电极反应式就不同,如氢氧燃料电池,在酸性介质和碱性介质中的电极反应式就不同.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
17.某烃和Cl2充分加成的产物其结构简式为 ,则原有机物一定是( )
,则原有机物一定是( )
 ,则原有机物一定是( )
,则原有机物一定是( )| A. | 2-丁炔 | B. | 2-甲基-1,4-二氯-2-丁烯 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二烯 |
18.下列烃的含氧衍生物中,只能与金属钠反应,不与碳酸氢钠溶液反应的是( )
| A. | CH2=CHCHO | B. | 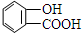 | C. | CH3COOCH3 | D. | 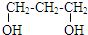 |
2.某同学在实验报告中有以下的实验数据:
①用托盘天平称取11.7g食盐
②用量筒量取5.26mL盐酸
③用广泛pH试纸测得溶液的pH是3.5
④用标准NaOH溶液滴定未知浓度的盐酸,用去23.10mL NaOH溶液.
其中数据合理的是( )
①用托盘天平称取11.7g食盐
②用量筒量取5.26mL盐酸
③用广泛pH试纸测得溶液的pH是3.5
④用标准NaOH溶液滴定未知浓度的盐酸,用去23.10mL NaOH溶液.
其中数据合理的是( )
| A. | ①②③ | B. | ①③④ | C. | ①②③④ | D. | ①④ |
12.下列有关叙述正确的是( )
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越强 |
19.根据如表五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
(1)在周期表中,最可能处于同一族的是E
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.
16.将分别盛有熔融NaCl、MgCl2、Al2O3(熔有冰晶石)的三个电解槽,在一定条件下通电一段时间后,析出Na、Mg、Al的物质的量之比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
17.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且的值与温度高低有关.当n(KOH)=a mol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后=11,则溶液中= | |
| B. | 参加反应的氯气的物质的量等于a mol | |
| C. | 改变温度,产物中KClO的最大理论产量为a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为a mol |