题目内容
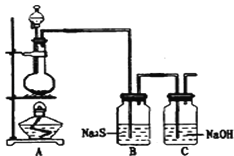
【题目】在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。实验结果与预测的现象一致的是( )
选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
|
A | 浓盐酸 | MnO2 固体 | 立即产生大量黄绿色气体 | |
B | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生大量气体 | |
C | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
D | NaOH 溶液 | 用砂纸打磨过的铝条 | 产生大量气体 |
A.AB.BC.CD.D
【答案】D
【解析】
A. 浓盐酸与二氧化锰反应需要加热,图中缺少加热装置,不能立即产生大量黄绿色气体,A错误;
B. 稀盐酸首先与氢氧化钠反应,此过程无气体生成,所以不会立即产生大量气体,B错误;
C. 在常温下,铝在浓硝酸中发生“钝化”,不会产生气体,C错误;
D. 氢氧化钠溶液与铝反应生成偏铝酸钠和氢气,产生大量气体,D正确;
故答案为:D。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是________(填字母)。
A.Na与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | a | b | c |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=_________kJ·mol-1(用a、b、c表示)
②通过物质所含能量计算。已知反应中A+B= C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应H=_________。
(3)已知:4g CH4完全燃烧生成CO2(g)、H2O(l)时放出热量222.5 kJ,则表示甲烷燃烧的热化学方程式为________。
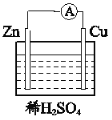
(4)下图所示装置可以说明有化学能转化为电能的实验现象为__________。