题目内容
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
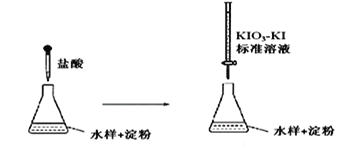
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
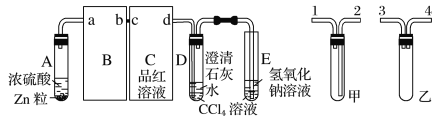
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
【答案】还原2H++S2O32-=SO2+S↓+H2O溶液由蓝色变为无色且30秒内不变色偏大10x浓盐酸淡黄色沉淀生成吸收氯气,避免空气污染
【解析】
(1)红酒中添加一定量的SO2可以防止酒液氧化,作还原剂;(2)根据现象写出离子方程式;(3)①碘单质具有氧化性,且淀粉遇碘变蓝;②通过分析消耗标准液的多少分析误差;③消耗1mL标准溶液相当于SO32-的质量1g,100mL水样相当于SO32-的质量xg,以此计算; (4) ①从实验室制取氯气的原理分析;②氯气与硫化钠反应生成硫与硫化钠;③碱液吸收尾气。
详解: (1)红酒中添加一定量的SO2可以防止酒液氧化,作抗氧化剂,体现其还原性,因此,本题正确答案是:还原;
(2)在酸性条件下,溶液中的H+与S2O32-发生反应: 2H++S2O32-=SO2+S↓+H2O,因此,本题正确答案是: 2H++S2O32-=SO2+S↓+H2O。
(3)①KIO3 和KI 在盐酸作用下析出I2,生成的I2遇淀粉溶液变蓝,因此滴定到终点时的现象是: 溶液由蓝色变为无色且30秒内不变色;
② 盛标准液的滴定管没有用标准液润洗,则标准液被稀释,滴定时消耗标准液的体积偏大,则测定结果将偏大。
③消耗1mL标准溶液相当于SO32-的质量1g,100mL水样相当于SO32-的质量xg,,则该水样中SO 32- 的含量为![]() =10x g / L
=10x g / L
因此,本题正确答案是: 溶液由蓝色变为无色且30秒内不变色;偏大 ;10x
(4)①为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸。故答案为:浓盐酸;
②在B中发生氯气置换出硫的反应,化学方程式为:Na2S+Cl2=2NaCl+S↓。故答案为:有淡黄色沉淀生成;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是

容器 编号 | 温度/K | 起始物质的量/mol | |||
SO2 | NO | NO2 | S | ||
Ⅰ | 0.5 | 0.6 | 0 | 0 | |
Ⅱ | T1 | 0.5 | 1 | 0.5 | 1 |
Ⅲ | T2 | 0.5 | 0.2 | 1 | 1 |
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%