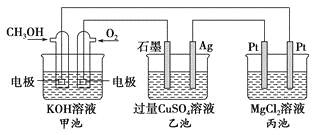
题目内容
【题目】研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)→2H2(g)+2CO(g)。
(1)该反应的平衡常数K=__。在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,则v(CH4)__。
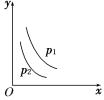
(2)根据如图可得出n(CO2)消耗__n(CH4)消耗(填“>”、“<”和“=”,原因是___。

【答案】 0.005mol/(L·min) > 有水生成,平衡时n(H2)<n(CO),说明部分CO2和H2发生了反应
0.005mol/(L·min) > 有水生成,平衡时n(H2)<n(CO),说明部分CO2和H2发生了反应
【解析】
(1)平衡常数K=生成物浓度的幂之积/反应物浓度的幂之积;据此写出该反应的平衡常数K的表达式;根据30min后CH4的质量的变化量,求出变化的浓度,根据v(CH4)=c/t进行计算;
(2)根据图中信息,有水生成,平衡时n(H2)<n(CO),所以反应中二氧化碳的消耗量大于甲烷的消耗量,说明部分CO2和H2发生了反应。
(1)已知CH4(g)+CO2(g)=2H2(g)+2CO(g),根据平衡常数的定义可知,该反应的平衡常数K= ;在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,减小的甲烷的物质的量为4.8g/16g/mol=0.3mol,浓度的变化为0.3mol/2L=0.15mol/L;则v(CH4)=c/t=0.15mol/L/30min=0.005mol/(L·min);
;在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,减小的甲烷的物质的量为4.8g/16g/mol=0.3mol,浓度的变化为0.3mol/2L=0.15mol/L;则v(CH4)=c/t=0.15mol/L/30min=0.005mol/(L·min);
故答案是: ;0.005mol/(L·min) ;
;0.005mol/(L·min) ;
(2)根据图中信息,有水生成,平衡时n(H2)<n(CO),所以反应中二氧化碳的消耗量大于甲烷的消耗量, 即n(CO2)消耗大于n(CH4)消耗;说明部分CO2和H2发生了反应;
故答案是:> ;有水生成,平衡时n(H2)<n(CO),说明部分CO2和H2发生了反应。