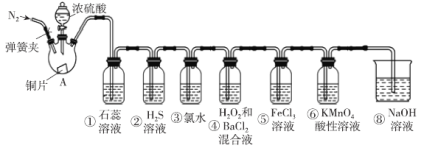
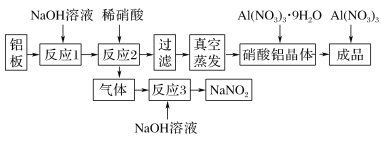
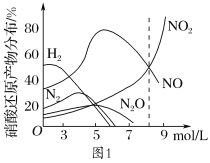
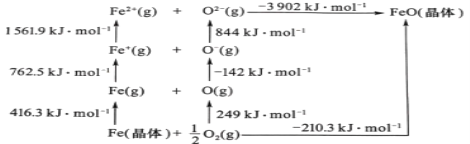题目内容
【题目】1L稀硝酸和稀硫酸的混合溶液中,硝酸和硫酸的物质的量浓度均为![]() 。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为
。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】C
【解析】
铜不能与稀硫酸反应,但能够与稀硝酸反应:3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O;但写成离子方程式:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,即可发现氢离子和硝酸根并不是1:1消耗,而是4:1消耗,同时稀硫酸也能提供氢离子去参与反应,计算得溶液中n(H+)=0.3mol,n(NO3-)=0.1mol,为3:1,对比发现H+先消耗完,故将氢离子物质的量带入离子方程式,发生反应的n(Cu)=n(H+)×3/8=9/80,m(Cu)=n(Cu)×64=7.2g。
故选:C。

练习册系列答案
相关题目