题目内容
2.往Na2S、Na2SO3的混合物中加入稀硫酸,反应中不可能生成的物质是( )| A. | S | B. | SO2 | C. | H2S | D. | SO3 |
分析 硫酸的酸性强于氢硫酸、亚硫酸,硫酸与Na2S、Na2SO3分别发生反应,生成硫化氢,亚硫酸,亚硫酸具有弱的氧化性,能够氧化硫化氢反应生成硫单质,据此解答.
解答 解:硫酸的酸性强于氢硫酸、亚硫酸,硫酸与Na2S、Na2SO3分别发生反应,方程式:Na2S+H2SO4=H2S+Na2SO4;Na2SO3+H2SO4=H2SO3+Na2SO4,亚硫酸不稳定分解生成二氧化硫和水,亚硫酸具有弱的氧化性,能够氧化硫化氢反应生成硫单质,方程式:H2SO3+2H2S=3S+3H2O,能够生成产物为S、SO2、H2S,
故选:D.
点评 本题考查了硫及其化合物转化,熟悉相关物质的性质是解题关键,注意二氧化硫具有弱的氧化性,题目不难.

练习册系列答案
相关题目
12.下列物质以任意比例混合,若总物质的量一定,则充分燃烧消耗氧气及生成水的量均相等的是( )
| A. | C2H6,C2H6O | B. | C3H6,C4H6O2 | C. | C2H2,C2H4O | D. | C3H6O,C4H8O2 |
10.下列说法中,正确的是( )
| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 实验室制取乙烯时,常伴有刺激性气味的气体产生,说明部分乙醇被氧化为乙醛 | |
| C. | 凡是能发生银镜反应的物质一定是醛或羧酸中的甲酸 | |
| D. | 向苯酚钠溶液中通入过量的二氧化碳气体时,生成物不可能是碳酸钠 |
7.下列说法错误的是( )
| A. | 作半导体材料的元素大多数位于周期表中金属元素和非金属元素的交界处 | |
| B. | 农药中常含有的元素通常在元素周期表的右上方区域内 | |
| C. | 构成催化剂的元素通常在元素周期表的左下方区域内 | |
| D. | 在周期表过渡元素中寻找作耐高温和耐腐蚀的合金材料的元素 |
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 在1 mol NaHSO4晶体中,含阳离子数为2NA | |
| B. | 1 mol C4H10分子中共价键总数为13NA | |
| C. | 0.5 mol•L-1 Ba(NO3)2溶液中,NO${\;}_{3}^{-}$的数目为NA | |
| D. | 任何条件下,20 L N2含有的分子数都不可能为NA |
11.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| B. | 0.1molNa2O2晶体中含有0.3NA个离子 | |
| C. | pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
12.在一定条件下,某密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g).反应物N2的浓度10s内从2mol/L降为1mol/L,在这段时间内用N2浓度的变化表示的反应速率为( )
| A. | 0.05 mol/(L•s) | B. | 0.1 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 0.2 mol/(L•s) |
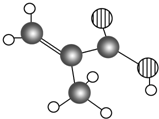 某化工厂产品只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂产品只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键,如单键、双键等). .
.