题目内容
10.下列说法中,正确的是( )| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 实验室制取乙烯时,常伴有刺激性气味的气体产生,说明部分乙醇被氧化为乙醛 | |
| C. | 凡是能发生银镜反应的物质一定是醛或羧酸中的甲酸 | |
| D. | 向苯酚钠溶液中通入过量的二氧化碳气体时,生成物不可能是碳酸钠 |
分析 A.应防止生成AgOH沉淀;
B.刺激性气体可能为二氧化硫;
C.能发生银镜反应,说明含有醛基;
D.通入过量的二氧化碳,肯定生成碳酸氢钠.
解答 解:A.溴乙烷在碱性条件下水解,水解后应先加入硝酸酸化,防止生成AgOH沉淀,故A错误;
B.浓硫酸具有脱水性和氢氧化钠,可与乙醇反应生成具有刺激性的二氧化硫,故B错误;
C.能发生银镜反应,说明含有醛基,可能为醛、葡萄糖、甲酸以及甲酸酯等,故C错误;
D.因苯酚酸性比碳酸氢钠强,通入过量的二氧化碳,肯定生成碳酸氢钠,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的性质的异同以及检验、鉴别方法,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.只用水就能鉴别的一组物质是( )
| A. | 苯、乙酸、四氯化碳 | B. | 乙醇、乙醛、乙酸 | ||
| C. | 溴苯、乙二醇、硝基苯 | D. | 乙酸乙酯、乙醇、甘油 |
18.下列说法中不正确的是( )
| A. | 已知C+CO2═2CO是吸热反应,当温度升高时,v正增大,v逆减少 | |
| B. | 两个非金属原子之间形成的化学键一定是共价键 | |
| C. | 含有离子键的物质不可能是单质 | |
| D. | 单质中不一定含有共价键 |
5.下表列出了A-R9种元素在周期表中的位置
(1)这九种元素中:化学性质最不活泼的是Ar;金属性最强的是:K,最高价氧化物的水化物碱性最强的碱的电子式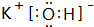 ,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2 H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg,离子半径顺序为:K+>Na+>Mg2+
(4)F的最常见氢化物的电子式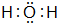 ;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
(5)C元素跟G元素形成的化合物的电子式是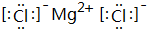 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 .
.
(6)G元素和H元素,A元素和B元素核电荷数之差分别为18、8.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
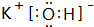 ,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2 H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg,离子半径顺序为:K+>Na+>Mg2+
(4)F的最常见氢化物的电子式
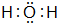 ;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.(5)C元素跟G元素形成的化合物的电子式是
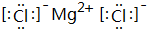 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 .
.(6)G元素和H元素,A元素和B元素核电荷数之差分别为18、8.
2.往Na2S、Na2SO3的混合物中加入稀硫酸,反应中不可能生成的物质是( )
| A. | S | B. | SO2 | C. | H2S | D. | SO3 |
19.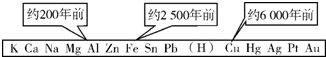 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.如图表示了三种金属被人类开发利用的大致年限,金属被利用年限的先后主要取决于( )
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.如图表示了三种金属被人类开发利用的大致年限,金属被利用年限的先后主要取决于( )
 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.如图表示了三种金属被人类开发利用的大致年限,金属被利用年限的先后主要取决于( )
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.如图表示了三种金属被人类开发利用的大致年限,金属被利用年限的先后主要取决于( )| A. | 金属的导电性强弱 | B. | 金属在地壳中的含量多少 | ||
| C. | 金属的化合价高低 | D. | 金属的活动性强弱 |
20.常温下,下列说法正确的是( )
| A. | 往CH3COOH溶液中加水,c(OHˉ)和c(H+)均增大 | |
| B. | 物质的量浓度均为0.1mol•Lˉ1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)<c(CH3COOˉ) | |
| C. | 某浓度的氯化铵溶液中存在c(NH4+)>c(Clˉ)>c(H+)>c(OHˉ) | |
| D. | 在pH=4的氯化铵溶液中c(H+)+c(NH4+)=c(Clˉ)+c(OHˉ) |
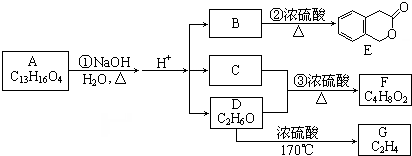
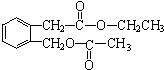 ;B的分子式是C9H10O3.
;B的分子式是C9H10O3.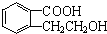 、
、 、
、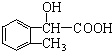 .
.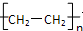 .
. 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.