题目内容
17.某含氧有机化合物,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,经红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基.(1)求该化合物的分子式,(2)请写出其结构简式.
分析 (1)根据有机物各元素的质量分数计算原子个数比值,求出最简式,根据相对分子质量计算出该有机物的化学式;
(2)根据该有机物分子式及结构特点确定其结构简式.
解答 解:(1)N(C):N(H):N(O)=$\frac{68.2%}{12}$:$\frac{13.6}{1}$:$\frac{1-68.2%-13.6%}{16}$=5:12:1,即该有机化合物的最简式为C5H12O,设其组成为(C5H12O)n,则(5×12+12×1+16)n=88.0,解得n=1,有机物的分子式为C5H12O,
答:该有机物的分子式为C5H12O;
(2)由于该有机物经红外光谱测定含有一个羟基、分子中有3个甲基,故满足条件的结构简式有:(CH3)2C(OH)CH2CH3、(CH3)2CHCH(OH)CH3、(CH3)3CCH2OH,
答:该有机物可能的结构简式有(CH3)2C(OH)CH2CH3、(CH3)2CHCH(OH)CH3、(CH3)3CCH2OH.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,注意掌握常见有机物结构与性质,明确同分异构体的概念及书写原则,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.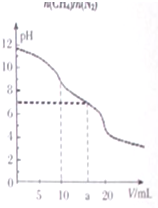 常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-) | |
| B. | 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
8.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 欲除去混在苯中的少量苯酚,可加入过量溴水,过滤 | |
| C. | 乙烷和丙烯的物质的量各1mol,完全燃烧各生成3molH2O | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
5.下表列出了A-R9种元素在周期表中的位置
(1)这九种元素中:化学性质最不活泼的是Ar;金属性最强的是:K,最高价氧化物的水化物碱性最强的碱的电子式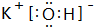 ,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2 H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg,离子半径顺序为:K+>Na+>Mg2+
(4)F的最常见氢化物的电子式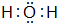 ;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
(5)C元素跟G元素形成的化合物的电子式是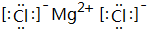 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 .
.
(6)G元素和H元素,A元素和B元素核电荷数之差分别为18、8.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
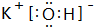 ,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2 H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg,离子半径顺序为:K+>Na+>Mg2+
(4)F的最常见氢化物的电子式
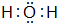 ;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.(5)C元素跟G元素形成的化合物的电子式是
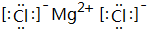 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 .
.(6)G元素和H元素,A元素和B元素核电荷数之差分别为18、8.
12.下列说法中不正确的是( )
| A. | 用石灰石-石膏法可以消除燃煤烟气中的二氧化硫,同时还得到副产品石膏(CaSO3•2H2O)和亚硫酸铵 | |
| B. | 利用太阳能光电转化材料组装的器件,只要光电转化效率都达到10%,利用太阳投射到地球上能量的0.1%就能满足当前全世界能源需要 | |
| C. | 借助扫描隧道显微镜,能实现对原子或分子的操纵 | |
| D. | 道尔顿提出的原子学说、阿伦尼乌斯创立的电离学说、门捷列夫提出的元素周期律都对化学学科的发展作出了重要的贡献 |
2.往Na2S、Na2SO3的混合物中加入稀硫酸,反应中不可能生成的物质是( )
| A. | S | B. | SO2 | C. | H2S | D. | SO3 |
9.有机物分子中原子之间(或原子与原子团之间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 乙醇不能与NaOH溶液反应,苯酚则能跟NaOH溶液反应 | |
| B. | 乙醛一定条件下能与氢气发生加成反应,乙酸一般不能与氢气发生加成反应 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,甲苯则能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
6.室温下进行的下列实验,不能达到预期目的是序号( )
| 序号 | 实验内容 | 实验目的 |
| A | 测定相同浓度的NaClO溶液,CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向Mg(OH)2浊液中滴加少量0.1mol/LFeCl3溶液 | 比较Mg(OH)2和Fe(OH)3的溶解度 |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 向同体积同浓度H2O2溶液中,分别加入1mol通浓度的CuSO4,FeCl3溶液 | 比较Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
7.核外电子层结构相同的一组微粒是( )
| A. | Mg2+、Al3+、Cl-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ar | D. | Mg2+、Na+、Cl-、S2- |