题目内容
12.在一定条件下,某密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g).反应物N2的浓度10s内从2mol/L降为1mol/L,在这段时间内用N2浓度的变化表示的反应速率为( )| A. | 0.05 mol/(L•s) | B. | 0.1 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 0.2 mol/(L•s) |
分析 先计算氮气的浓度变化量,再根据v=$\frac{△c}{△t}$计算氮气表示的反应速率.
解答 解:反应物N2的浓度10s内从2mol/L降为1mol/L,则△c(N2)=2mol/L-1mol/L=1mol/L,则v(N2)=$\frac{1mol/L}{10s}$=0.1 mol/(L•s),故选B.
点评 本题考查化学反应速率计算,比较基础,注意对公式的理解与灵活应用,有利于基础知识的巩固.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
2.往Na2S、Na2SO3的混合物中加入稀硫酸,反应中不可能生成的物质是( )
| A. | S | B. | SO2 | C. | H2S | D. | SO3 |
20.常温下,下列说法正确的是( )
| A. | 往CH3COOH溶液中加水,c(OHˉ)和c(H+)均增大 | |
| B. | 物质的量浓度均为0.1mol•Lˉ1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)<c(CH3COOˉ) | |
| C. | 某浓度的氯化铵溶液中存在c(NH4+)>c(Clˉ)>c(H+)>c(OHˉ) | |
| D. | 在pH=4的氯化铵溶液中c(H+)+c(NH4+)=c(Clˉ)+c(OHˉ) |
7.核外电子层结构相同的一组微粒是( )
| A. | Mg2+、Al3+、Cl-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ar | D. | Mg2+、Na+、Cl-、S2- |
4.合成结构简式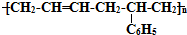 的高聚物,其单体是( )
的高聚物,其单体是( )
①苯乙烯 ②丁烯 ③1,3-丁二烯 ④丙炔 ⑤苯丙烯.
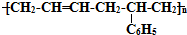 的高聚物,其单体是( )
的高聚物,其单体是( )①苯乙烯 ②丁烯 ③1,3-丁二烯 ④丙炔 ⑤苯丙烯.
| A. | ①② | B. | ④⑤ | C. | ③⑤ | D. | ①③ |
11.下列分子中,原子的最外层电子数均满足8电子稳定结构的是( )
| A. | NH3 | B. | SiCl4 | C. | BF3 | D. | PCl5 |