题目内容
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 在1 mol NaHSO4晶体中,含阳离子数为2NA | |
| B. | 1 mol C4H10分子中共价键总数为13NA | |
| C. | 0.5 mol•L-1 Ba(NO3)2溶液中,NO的数目为NA | |
| D. | 任何条件下,20 L N2含有的分子数都不可能为NA |
分析 A、NaHSO4晶体只能电离为Na+和HSO4-;
B、1molC4H10中含13mol共价键;
C、溶液体积不明确;
D、氮气的状态不明确,气体摩尔体积可能为20L/mol.
解答 解:A、NaHSO4晶体只能电离为Na+和HSO4-,1mol NaHSO4晶体中,含阳离子1mol,个数为NA,故A错误;
B、1molC4H10中含10molC-H键,3molC-C键,即共13mol共价键,即13NA个,故B正确;
C、溶液体积不明确,NO的数目无法计算,故C错误;
D、氮气的状态不明确,气体摩尔体积可能为20L/mol,故20 L N2的物质的量可能为1mol,故分子数可能为NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.能形成A2B型离子化合物的两种元素的原子序数是( )
| A. | 20和8 | B. | 1和6 | C. | 11和16 | D. | 12和17 |
5.下表列出了A-R9种元素在周期表中的位置
(1)这九种元素中:化学性质最不活泼的是Ar;金属性最强的是:K,最高价氧化物的水化物碱性最强的碱的电子式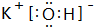 ,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2 H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg,离子半径顺序为:K+>Na+>Mg2+
(4)F的最常见氢化物的电子式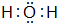 ;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
(5)C元素跟G元素形成的化合物的电子式是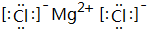 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 .
.
(6)G元素和H元素,A元素和B元素核电荷数之差分别为18、8.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
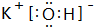 ,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2 H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg,离子半径顺序为:K+>Na+>Mg2+
(4)F的最常见氢化物的电子式
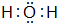 ;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.(5)C元素跟G元素形成的化合物的电子式是
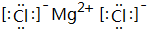 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 .
.(6)G元素和H元素,A元素和B元素核电荷数之差分别为18、8.
2.往Na2S、Na2SO3的混合物中加入稀硫酸,反应中不可能生成的物质是( )
| A. | S | B. | SO2 | C. | H2S | D. | SO3 |
9.有机物分子中原子之间(或原子与原子团之间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 乙醇不能与NaOH溶液反应,苯酚则能跟NaOH溶液反应 | |
| B. | 乙醛一定条件下能与氢气发生加成反应,乙酸一般不能与氢气发生加成反应 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,甲苯则能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
19.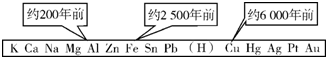 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.如图表示了三种金属被人类开发利用的大致年限,金属被利用年限的先后主要取决于( )
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.如图表示了三种金属被人类开发利用的大致年限,金属被利用年限的先后主要取决于( )
 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.如图表示了三种金属被人类开发利用的大致年限,金属被利用年限的先后主要取决于( )
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.如图表示了三种金属被人类开发利用的大致年限,金属被利用年限的先后主要取决于( )| A. | 金属的导电性强弱 | B. | 金属在地壳中的含量多少 | ||
| C. | 金属的化合价高低 | D. | 金属的活动性强弱 |
6.室温下进行的下列实验,不能达到预期目的是序号( )
| 序号 | 实验内容 | 实验目的 |
| A | 测定相同浓度的NaClO溶液,CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向Mg(OH)2浊液中滴加少量0.1mol/LFeCl3溶液 | 比较Mg(OH)2和Fe(OH)3的溶解度 |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 向同体积同浓度H2O2溶液中,分别加入1mol通浓度的CuSO4,FeCl3溶液 | 比较Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
4.合成结构简式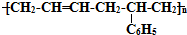 的高聚物,其单体是( )
的高聚物,其单体是( )
①苯乙烯 ②丁烯 ③1,3-丁二烯 ④丙炔 ⑤苯丙烯.
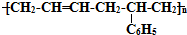 的高聚物,其单体是( )
的高聚物,其单体是( )①苯乙烯 ②丁烯 ③1,3-丁二烯 ④丙炔 ⑤苯丙烯.
| A. | ①② | B. | ④⑤ | C. | ③⑤ | D. | ①③ |
