题目内容
4.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L/、0.08mol/L,下列判断不合理的是( )| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
分析 A、起始浓度-变化浓度=平衡浓度,X、Y的化学计量数为1:3,平衡时浓度为1:3,则起始X、Y的起始浓度为1:3;
B、Y的生成速率,表示逆反应速率,Z的生成速率表示正反应速率,不同物质表示的正逆反应速率等于化学计量数之比,可逆反应到达平衡状态;
C、根据起始量以及转化量判断转化率关系;
D、应向正反应进行建立平衡,X起始浓度之和最大,反应向逆反应进行建立平衡,X起始浓度之和最小,结合极限法计算.
解答 解:A、X、Y的化学计量数为1:3,所以X、Y的浓度变化之比为1:3,平衡时浓度为1:3,起始浓度=变化浓度+平衡浓度,则起始X、Y的起始浓度为(1+1):(3+3)=1:3,故A正确;
B、不同物质表示的正逆反应速率等于化学计量数之比,可逆反应到达平衡状态,Y的生成速率表示逆反应速率,Z的生成速率表示正反应速率,所以平衡时X和Z的生成速率之比为1:2,故B正确;
C、反应起始时c1:c2=l:3,由方程式可知,反应物的物质的量变化量与化学计量数呈正比,转化的物质的量也为1:3,则转化率应相等,故C错误;
D、平衡时X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,若反应向正反应进行建立平衡,X起始浓度最大,将Z极限法转化为左边,结合X(g)+3Y(g)?2Z(g)可知,X的浓度变化为0.04mol/L,故X的极大值为0.1mol/L+0.04mol/L=0.14mol/L,
若反应向逆反应进行建立平衡,X起始浓度最小,平衡时X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,将X、Y极限法转化为右边,结合X(g)+3Y(g)?2Z(g)可知,Z的浓度变化为0.2mol/L,X、Y无剩余,故X的极小值为0,故X的起始浓度c1的取值范围为0<c1<0.14mol•L,故D正确;
故选C.
点评 本题考查化学平衡的计算,难度中等,理解可逆反应的不完全性与平衡建立途径,注意极限法在平衡判断中的运用.

 阅读快车系列答案
阅读快车系列答案| A. | 0.5mol/L | B. | 1mol/L | C. | 1.25mol/L | D. | 2.5mol/L |
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | Na2SO3和H2O2的反应为氧化还原反应 | |
| C. | 若某反应的反应物总能量低于生成物总能量,则该反应为放热反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
(2)基态锗(Ge)原子的价层电子排布式是4s24p2.Ge的最高价溴化物分子式是GeBr4.该元素可能的性质或应用有BD.
A.是一种活泼的金属元素 B.其单质可作为半导体材料
C.其元素的电负性大于硫元素 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物
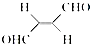 ,下列叙述正确的有AD.
,下列叙述正确的有AD.A.该分子在水中的溶解度大于2-丁烯
B.分子中只有极性键
C.分子中有7个σ键和1个π键
D.该化合物既能发生还原反应又能发生氧化反应
E.分子间可形成氢键
(4)NaF的熔点>
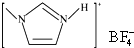 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1molNH4BF4含有2mol配位键.
| A. | pH=0的溶液中:ClO-、Cu2+、SO42-、K+ | |
| B. | 使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 能够和金属镁反应放出气体的溶液中:Na+、H+、SO42-、Cl- | |
| D. | 常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+ |