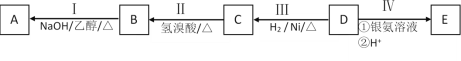
题目内容
【题目】锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、A12O3、SiO2等杂质)为原料制备锰酸锂的流程如图所示。
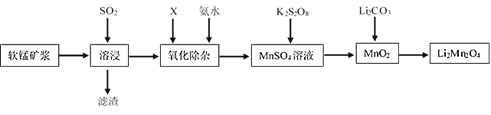
(1)溶浸生产中为提高SO2回收率可采取的措施有__(填序号)
A.不断搅拌,使SO2和软锰矿浆充分接触
B.增大通入SO2的流速
C.减少软锰矿浆的进入量
D.减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39,pH=7.1时Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+、Al3+(使其浓度小于1×l0-6mol/L),需调节溶液pH范围为__。
(3)由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式__。
(4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600℃750℃,制取产品LiMn2O4。写出该反应的化学方程式__。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC![]() LiMn2O4+C(0<x<1)
LiMn2O4+C(0<x<1)
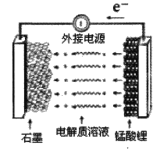
①充电时,电池的阳极反应式为__,若此时转移lmole-,则石墨电极将增重__g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是__。
【答案】AD 5.0≤pH<7.1 Mn2++S2O82-+2H2O=MnO2↓+4H++2SO42- 8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑ LiMn2O4-xe-=Li1-xMn2O4+xLi+ 7 拆解环境保持干燥,拆解下的锂隔绝空气保存
4LiMn2O4+2CO2↑+O2↑ LiMn2O4-xe-=Li1-xMn2O4+xLi+ 7 拆解环境保持干燥,拆解下的锂隔绝空气保存
【解析】
软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3和极少量铜的化合物等杂质,利用软锰矿浆脱含硫烟气中SO2,发生反应MnO2+SO2=MnSO4,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,步骤Ⅱ中在浸出Ⅰ中加入氧化剂将亚铁离子氧化为铁离子,加入氨水调节溶液pH沉淀Fe3+、Al3+便于除去,过滤得到滤液含有的Mn2+的溶液中加入K2S2O8可将Mn2+氧化为MnO2,K2S2O8被还原为K2SO4,MnO2与Li2CO3在一定温度下发生反应,产生LiMn2O4、CO2、O2,据此分析解答。
(1)A.不断搅拌,使SO2和软锰矿浆充分接触,这样SO2就会更多转化为SO42-,故A正确;
B.增大通入SO2的流速,可能会导致部分SO2未来得及反应就逸出,物质的产率降低,故B错误;
C.减少软锰矿浆的进入量,SO2可能不能及时参加反应,导致回收率降低,故C错误;
D.减小通入SO2的流速,SO2能尽可能充分反应,回收率增大,故D正确;
故答案选AD;
(2)除杂时显然只能除去Fe3+和Al3+,不能损失Mn2+,由题意可知,室温下,pH=7.1时Mn(OH)2开始沉淀,除去MnSO4溶液中的Fe3+、Al3+,氢氧化铝完全变成沉淀时的Ksp[Al(OH)3]=1×10-33=c(Al3+)c3(OH-),c(Al3+)=1×10-6mol/L,解得:c(OH-)=1×10-9mol/L,则溶液c(H+)=l×10-5mol/L,则pH=5;同理Fe(OH)3完全变成沉淀时,Ksp[Fe(OH)3]=l×10-39=c(Fe3+)c3(OH-),c(Fe3+)=1×10-6mol/L,解得:c(OH-)=1×10-11mol/L,c(H+)=l×10-3mol/L,则pH约为3,故pH范围是:5.0≤pH<7.1;
(3)由题意可知,反应物为MnSO4和K2S2O8,生成物之一为MnO2,再根据化合价升降相等和原子守恒配平,则发生反应的离子反应方程式为Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
(4)MnO2和Li2CO3反应后只有Mn的价态降低,必然有元素的化合价升高,C元素处在最高价态,不能升高,则只能是O元素价态升高,所以还有O2生成。根据电子守恒、原子守恒,可得该反应的方程式为:8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑;
4LiMn2O4+2CO2↑+O2↑;
(5)①放电时,电池的正极发生还原反应,反应式为Li1-xMn2O4+xLi++xe-=LiMn2O4,充电时电池的阳极反应式为:LiMn2O4-xe-=Li1-xMn2O4+xLi+;此时,石墨电极上发生的反应为C+xe-+xLi+=LixC,则转移lmole-石墨电极将增重的质量为1molLi+的质量,由于Li摩尔质量是7g/mol,所以1molLi+的质量是7.0g;
②废旧锰酸锂电池可能残留有单质锂,锂化学性质活泼,锂可与空气中的O2和H2O反应,对拆解的要求是:隔绝空气和水分。