题目内容
【题目】有机物J是一种医药中间体,可通过如下图示路线合成。

已知:![]()
请回答以下问题:
(1)B的结构简式是___________,D的结构简式是___________。
(2)在一定条件下,两个F分子发生分子间脱水生成一种环状酯,该环状酯的结构简式为_______。
(3)A与足量的银氨溶液溶液反应的化学方程式是_________。
(4)J与足量的氢氧化钠溶液反应的化学方程式是__________。
(5)满足以下条件的G的同分异构体(不含G)共有________种;
①含有酯基; ②能与氯化铁溶液发生显色反应
【答案】CH3COOH ![]()
![]() CH3CHO + 2Ag(NH3)2OH
CH3CHO + 2Ag(NH3)2OH![]() CH3COONH4 + 2Ag↓+ 3NH3 + H2O
CH3COONH4 + 2Ag↓+ 3NH3 + H2O 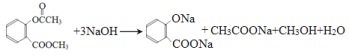 18
18
【解析】
由合成流程可知,CH2=CH2氧化生成A为CH3CHO,A氧化生成B为CH3COOH,B发生取代反应生成C;结合F、J的结构可知,F发生酯化反应生成G,G为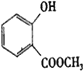 ,则甲苯发生取代反应生成D为
,则甲苯发生取代反应生成D为![]() ,D发生氧化反应生成E,E发生水解反应得到F(邻醛基苯甲酸),F与甲醇发生酯化反应得到G,以此来解答。
,D发生氧化反应生成E,E发生水解反应得到F(邻醛基苯甲酸),F与甲醇发生酯化反应得到G,以此来解答。
(1)根据分析可知B的结构简式是CH3COOH,D的结构简式是![]() ,故答案为:CH3COOH;
,故答案为:CH3COOH;![]() ;
;
(2)在一定条件下,两个F分子发生分子间脱水生成一种环状酯,该环状酯的结构简式为 ,故答案为:
,故答案为: ;
;
(3)A为CH3CHO,醛基可以被银氨溶液氧化,所以A与足量的银氨溶液溶液反应的化学方程式是CH3CHO + 2Ag(NH3)2OH![]() CH3COONH4 + 2Ag↓+ 3NH3 + H2O,故答案为:CH3CHO + 2Ag(NH3)2OH
CH3COONH4 + 2Ag↓+ 3NH3 + H2O,故答案为:CH3CHO + 2Ag(NH3)2OH![]() CH3COONH4 + 2Ag↓+ 3NH3 + H2O;
CH3COONH4 + 2Ag↓+ 3NH3 + H2O;
(4)J中含有酯基,可以在氢氧化钠溶液中发生水解,水解产物中含有酚羟基,也可以氢氧化钠发生反应,所以J与足量的氢氧化钠溶液反应的化学方程式是 ,故答案为:
,故答案为: ;
;
(5)G为![]() ,①含有酯基;②能与氯化铁溶液发生显色反应,则一定含酚-OH,苯环上有两个取代基,为-OH、-COOCH3,或-OH、-OOCCH3,或-OH、-CH2OOCH,均存在邻、间、对位置,有3×3-1=8种;若含3个取代基,分别为-OH、-OOCH、CH3、两个取代基为邻位时-COOH有4种位置,两个取代基为间位时-COOH有4种位置,两个取代基为对位时-COOH有2种位置,共4+4+2=10种,满足以下条件的G的同分异构体(不含G)共有8+10=18种,故答案为:18。
,①含有酯基;②能与氯化铁溶液发生显色反应,则一定含酚-OH,苯环上有两个取代基,为-OH、-COOCH3,或-OH、-OOCCH3,或-OH、-CH2OOCH,均存在邻、间、对位置,有3×3-1=8种;若含3个取代基,分别为-OH、-OOCH、CH3、两个取代基为邻位时-COOH有4种位置,两个取代基为间位时-COOH有4种位置,两个取代基为对位时-COOH有2种位置,共4+4+2=10种,满足以下条件的G的同分异构体(不含G)共有8+10=18种,故答案为:18。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

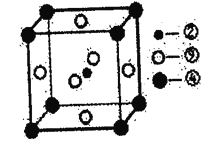
(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
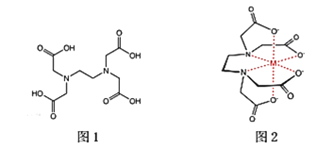
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。

(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |