题目内容
3.常温下,下列关于电解质溶液的说法正确的是( )| A. | pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等浓度的NaOH至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2moj/L的盐酸中加入等体积0.1mol/L氨水溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3••H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
分析 A、加水稀释醋酸能促进醋酸电离,电离方程式中的离子浓度均减小,由于Kw不变,因此c(OH-)增大;
B、当溶液pH值=7时,溶液中氢离子浓度等于氢氧根浓度,若是二者物质的量相等,生成了醋酸钠,溶液显示碱性,故氢氧化钠物质的量少些;
C、向0.2moj/L的盐酸中加入等体积0.1mol/L氨水溶液,二者反应生成浓度相等的盐酸和氯化铵的混合溶液,根据电荷守恒分析解答;
D、根据电荷守恒和物料守恒分析解答.
解答 解:A、加水稀释,电离方程式中的离子浓度均减小,由于Kw不变,因此c(OH-)增大,故A错误;
B、当溶液pH值=7时,溶液中氢离子浓度等于氢氧根浓度,若是二者物质的量相等,生成了醋酸钠,溶液显示碱性,故氢氧化钠物质的量少些,所以V(CH3COOH溶液)>V(NaOH溶液),故B错误;
C、向0.2moj/L的盐酸中加入等体积0.1mol/L氨水溶液,二者反应生成浓度相等的盐酸和氯化铵的混合溶液,根据电荷守恒c(Cl-)+c(OH-)=c(H+)+c(NH4+),而氯化铵溶液中氨根离子的水解极其微弱,所以c(NH3••H2O)<c(NH4+),则c(Cl-)+c(OH-)>c(H+)+c(NH3••H2O),故C错误;
D、根据电荷守恒可知:2c(SO42-)+c(OH-)=c(H+)+c(Na+),组成中(SO42-)=c(Na+),所以c(H+)=c(SO42-)+c(OH-),故D正确;
故选D.
点评 本题考查学生弱电解质在水溶液中的电离平衡以及应用知识,属于综合知识的考查题,难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
13.我国自主研发的生物航空煤油在今年三月首次商业载客飞行成功,该生物航空煤油是以“地沟油”为原料,进行裂化、加氢、去氧处理后得到的.下列说法错误的是( )
| A. | 有机化学中加氢和去氧都属于还原反应 | |
| B. | 裂化是化学变化,裂化产物是饱和烃 | |
| C. | “地沟油”的分子中含有不饱和键,加氢能改善其稳定性 | |
| D. | “地沟油”去氧时,氧主要以H2O和CO2等形式脱去 |
11.生活中处处有化学.下列说法不正确的是( )
| A. | 令人讨厌的地沟油可以用于制肥皂 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |
18.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
8.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( )
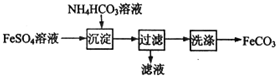

| A. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| B. | 沉淀过程中有CO2气体放出 | |
| C. | 过滤搡作的常用玻璃仪器有烧杯、漏斗和玻璃棒 | |
| D. | 产品FeCO3在空气中高温分解可得到纯净的FeO |
15.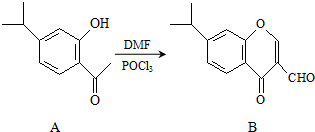 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中所有碳原子均位于同一平面 | |
| B. | 用FeCl3溶液可检验物质B中是否混有A | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与5mol H2发生加成反应 |
12.为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究.已知:碱式碳酸钴受热时可分解生成三种氧化物.
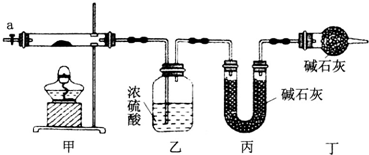
(1)按如图所示装置组装好仪器,并检查装置气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生时(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl2•6H2O的一种工艺如下:

已知;25℃时
①净化除杂时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.

(1)按如图所示装置组装好仪器,并检查装置气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生时(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl2•6H2O的一种工艺如下:

已知;25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
13.用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭.发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来,下列说法正确的是( )
| A. | 导致易拉罐变瘪的离子反应是CO2+OH-=HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是Al3++3HCO3-=Al(OH)3+3CO2↑ | |
| C. | 上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性 | |
| D. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 |
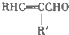 +H2O
+H2O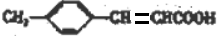 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$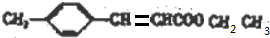 +H2O,反应类型为取代反应(酯化反应).
+H2O,反应类型为取代反应(酯化反应).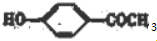 (写结构简式).
(写结构简式).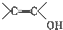 )结构.
)结构.