题目内容
11.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应可以制造价值更高的化学品. (1)250℃时,以镍合金为催化剂,向4L密闭容器中通入6molCO2、4molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分的浓度为:| 物质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol•L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
求反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3KJkJ•mol-1
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4?CH3COOH温度与催化剂的催化效率和乙酸的生成速率(如图1).请回答下列问题:
①250-300℃时,温度升高而乙酸的生成速率降低的原因是温度在250~300℃时,催化剂的催化效率降低
②为提高上述反应CH4的转化率,可采取的措施有增大反应压强、增大CO2的浓度(写2条)
(3)Li4SiO4可用于吸收、释放CO2,原理是:500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反方向和逆反应方向的条件):CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理(如图2)所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
c.300℃-350℃d.350℃-2050℃
②放电时,电极A为负极.
③充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS
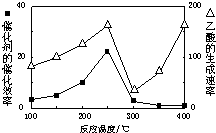
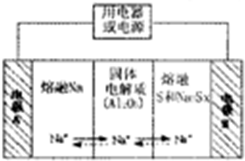
图1 图2.
分析 (1)①由题目可知在开始时CH4浓度为1mol/L,平衡时浓度为0.5mol/L,根据转化率公式进行计算;
②根据盖斯定律进行计算;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
②根据增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大分析;
(3)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3;
(4)①原电池工作时,控制的温度应为满足Na、S为熔融状态,据此分析;
②放电时,Na被氧化,应为原电池负极;
③充电时,是电解池反应,阳极反应为:Sx2--2e-=xS.
解答 解:(1)①由题目可知在开始时CH4浓度为1mol/L,平衡时浓度为0.5mol/L,故转化率为$\frac{1-0.5}{1}$×100%=50%,故答案为:50%;
②已知①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=(-890-2×2.8+(-566)×2 )kJ•mol-1=+247.3KJ/mol,
故答案为:247.3;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案为:温度在250~300℃时,催化剂的催化效率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大反应压强、增大CO2的浓度;
(3)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3,故答案为:CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3;
(4)①原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于A444.6℃,只有c符合,故答案为:c;
②放电时,Na被氧化,应为原电池负极,故答案为:负;
③充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故答案为:Sx2--2e-=xS.
点评 本题考查了综合利用CO2,涉及热化学反应、电化学、化学平衡影响因素等,较为综合,题目难度中等;同时还考查了原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极方程式的书写,答题时注意体会,难度不大.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| A. | 氧化亚铁能与酸反应,可用于制作红色涂料 | |
| B. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| C. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 维生素C是水溶性维生素,能增强人体抵抗力,有解毒作用 |
| A. | 房屋装修所用装饰材料释放出的甲醛、苯、氨等气体对人体无害,不会造成污染 | |
| B. | 食品包装袋小包内盛有装氧化钙或生石灰用作食品的抗氧化剂 | |
| C. | 制作航天服的聚酯纤维和“天宫一号”中使用的碳纤维都是新型无机非金属材料 | |
| D. | 绿色化学的核心就是利用化学原理从源头减少和消除工业对环境的污染 |
 A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:回答下列问题
| 元素 | 相关信息 |
| A | 元素A是周期表中原子半径最小的元素 |
| B | B的单质由双原子分子构成,分子中有14个电子 |
| C | C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌 |
| D | D是前四周期元素中第一电离能最小的元素 |
| E | E位于ds区且原子的最外层电子数与A相同 |
(1)C元素基态原子的价电子排布图为

(2)[E(A2C)4]2+中E2+与A2C间的作用为B(填字母编号
A.离子键 B.配位键 C.金属键 D.分子间作用力
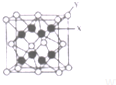
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则X应为K+
D2C的熔点比CaF2的熔点低(填“高”、“低”、“无法比较”)
(4)与B2C互为等电子体分子为CO2,其分子的立体构型为直线型
(5)已知:A2(g)+$\frac{1}{2}$C2(g)=A2C(g)△H1=-akJ/mol
B2(g)+3A2(g)=2BA3(g)△H2=-bkJ/mol
则34gBA3(g)与C2(g)反应生成B2(g)与A2C(g)时,该反应的热化学反应方程式为2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol.
| A. | 含有羟基的化合物一定属于醇类 | |
| B. | 含有跟链烃基相连的羟基的有机物一定是醇类 | |
| C. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| D. | 分子内有苯环和羟基的化合物一定是酚类 |
| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
(1)上述条件下该反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)能判断该反应达到化学平衡状态的依据是AB.
A.混合气体的压强保持不变
B.N2的浓度不再改变
C.消耗CO的物质的量与生成CO2的物质的量之比为1:1
D.NO、CO、CO2、N2的物质的量之比为2:2:2:1
(3)既要加快反应速率又要提高NO转化率,下列措施可行的是D.
A.选用更有效的催化剂B.升高反应体系的温度C.降低反应体系的温度D.缩小容器的体积
(4)为了测定在某种催化剂作用下的反应速率,某科学家在某温度下用气体传感器测得不同时间的NO和CO浓度如表(均不考虑温度变化对催化剂催化效率的影响):
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)( mol•L-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)( mol•L-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | c | 2.70×10-3 |
①c=2.70×10-3mol•L-1;
②前2s内的平均反应速率v(N2)=1.875×10-4mol/(L.s);
③该温度下反应的平衡常数K=5×103.