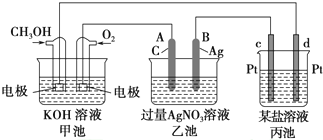
��Ŀ����
1����ѧ���ѧ����������ᡢ����������أ�����������ȷ���ǣ�������| A�� | ʯ���ѽ����ҪĿ����������͵������͵IJ�����������ʯ�ʹ��ѻ�����ҪĿ���ǵõ��������ϩ����ϩ����̬������ | |
| B�� | Ŀǰ��ѧ���Ѿ��Ƶõ�ԭ�Ӳ��࣬�����Ǩ�����ǹ��10��������ȡ��������������õľ���� | |
| C�� | ����β����ת��װ�ÿɽ�β���е�NO��CO���к�����ת��ΪN2��CO2����װ���еĴ����ɽ���NO��CO��Ӧ�Ļ�ܣ���������߸÷�Ӧ��ƽ��ת���� | |
| D�� | ���������ǹ��ұ����İ���������ʼ�������֮�ƣ���֪�ò����Ի�ѧҩƷ���У��Ҵ�������������Һ�����Խ������������ﵽ������Ŀ�� |
���� A�������ѽ���ѻ���Ŀ����������
B������ܲ���Ӧ���е����ԣ�
C���������ܸı�ƽ��ת���ʣ�
D���Ҵ�ʹ�����ʱ��ԣ�
��� �⣺A��ʯ�ʹ��ѻ���Ŀ����������͵������͵IJ������������ѽ��Ŀ���ǵõ�С���ӵ�ϩ������A����
B������ܲ���Ӧ���е����ԣ������Ǩ���ʱȹ�ǿ�������ڰ뵼����ϣ���B��ȷ��
C���������ܸı�ƽ��ת���ʣ�ֻ�ܼӿ췴Ӧ���ʣ���C����
D���Ҵ�����Һ��������Ϊ����ʹ�����ʱ��ԣ��������ǽ�����������������������Һ���Խ������������ﵽ������Ŀ�ģ���D����
��ѡB��
���� ���⿼��뵼������ʡ�ʯ�͵�ұ�������������ü������ʵı��Ե�֪ʶ���ѶȲ���Ҫע�����֪ʶ�Ļ��ۣ�

��ϰ��ϵ�д�
�����Ŀ
11��ͼ��ʾ����β�������������̣��й�������ȷ���ǣ�������
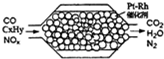

| A�� | ���������У�NOXֻ��CO��ԭ | |
| B�� | ��װ�þ�����������ʹ�ú�Ǧ���Ͳ��������Ⱦ | |
| C�� | ����22.4L��������״����ʱ��ת��4xmole- | |
| D�� | Pt-Rh���������β��ƽ��ת���� |
12�����з�Ӧ�����ӷ���ʽ�У�����ȷ���ǣ�������
| A�� | Na2SiO3��Һ�еμ�����ϡHCl�ƹ��ὺ�壺SiO32-+2H+�TH2SiO3�����壩 | |
| B�� | ��ϡHNO3��ϴ�Թܱ��ϵ�������3Ag+4H++NO3-�T3Ag++NO��+2H2O | |
| C�� | ��NH4��2SO4��Һ�����Ba��OH��2��Һ��ϣ�NH4++SO42-+Ba2++OH-�TBaSO4��+NH3•H2O | |
| D�� | SO2ͨ����ˮ�У�Cl2+SO2+2H2O�TSO42-+2Cl-+4H+ |
16������������ʵĵ���ƽ�ⳣ�����±�������˵������ȷ���ǣ�������
| ������� | HCOOH | HCN | H2CO3 | NH3•H2O |
| ����ƽ�ⳣ�� ��25�棩 | Ka=1.8��10-4 | Ka=4.9��10-10 | Ka1=4.3��10-7Ka2=5.6��10-11 | Kb=1.8��10-5 |
| A�� | ���H+��������CO32-��CN-��HCO3-��HCOO- | |
| B�� | 0.1mol/L��HCOONH4��Һ�У�c��HCOO-����c��NH4+����c��H+����c��OH-�� | |
| C�� | 25��ʱ��pH=3��������pH=11�İ�ˮ��ϣ�����Һ�����ԣ���������ĵ�����ǣ�V�����ᣩ��V����ˮ�� | |
| D�� | 0.1mol/L��NaHCO3��Һ�У�c��Na+��+c��H+��=c��HCO3-��+c��OH-��+c��CO32-�� |
6�������ǵ����ʴ�л�IJ��Ҳ����Ҫ�Ļ�ѧ���ϣ���ҵ�ϳ����ط�Ӧ���£�
2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��
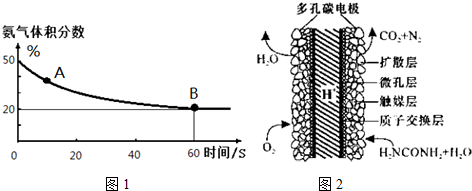
��1����һ����պ����ܱ������г���CO2��NH3����������Ӧ�ϳ����أ��㶨�¶��»�������еİ���������ͼ1��ʾ��A�������Ӧ����v����CO2����B����淴Ӧ����v����CO2�������������������=������
������ƽ��ת����Ϊ75%��
��2������������Ǻϳ����ص�һ���м����������Ϊ2��1��NH3��CO2����������һ���ݻ����������ܱ������У��ں㶨�¶���ʹ�䷢�����з�Ӧ���ﵽƽ�⣺2NH3��g��+CO2��g���TNH2COONH4��s��
��ʵ���õIJ�ͬ�¶��µ�ƽ�����������±���
�ٹ���������Ӧ���ʱ䡢�ر�˵����ȷ����A��
A����H��0����S��0B����H��0����S��0 C����H��0����S��0D����H��0����S��0
�ڹ���������Ӧ��ƽ��״̬����˵����ȷ����C
A������������İ�������泥���Ӧ���ת���ʽ�����
B��ƽ��ʱ������ϵ�¶ȣ�CO2����������½�
C��NH3��ת����ʼ�յ���CO2��ת����
D��������Ч�Ĵ����ܹ���߰�������淋IJ���
�۰�������識���ˮ���̼��泥���������ˮ������ף�����������立�ĩ����1L0.1mol/L��������Һ��ֱ��pH=7�������£�������Һ����仯��������ȥ0.052mol��������泥���ʱ��Һ�м�������̼Ԫ�أ�
��ʱ��Һ��c��NH4+��=0.1mol/L��
NH4+ˮ��ƽ�ⳣ��ֵΪ4��10-9��
��3����ѧ�������о����ض���ȼ�ϵ�أ���ҺҲ�ܷ��磡�����ֵ��ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ���ܷ��磮����ȼ�ϵ�ؽṹ��ͼ2��ʾ��д���õ�صĸ�����Ӧʽ��CO��NH2��2+H2O-6e-=CO2+N2+6H+��
2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��

��1����һ����պ����ܱ������г���CO2��NH3����������Ӧ�ϳ����أ��㶨�¶��»�������еİ���������ͼ1��ʾ��A�������Ӧ����v����CO2����B����淴Ӧ����v����CO2�������������������=������
������ƽ��ת����Ϊ75%��
��2������������Ǻϳ����ص�һ���м����������Ϊ2��1��NH3��CO2����������һ���ݻ����������ܱ������У��ں㶨�¶���ʹ�䷢�����з�Ӧ���ﵽƽ�⣺2NH3��g��+CO2��g���TNH2COONH4��s��
��ʵ���õIJ�ͬ�¶��µ�ƽ�����������±���
| �¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ��������Ũ�� ��10-3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A����H��0����S��0B����H��0����S��0 C����H��0����S��0D����H��0����S��0
�ڹ���������Ӧ��ƽ��״̬����˵����ȷ����C
A������������İ�������泥���Ӧ���ת���ʽ�����
B��ƽ��ʱ������ϵ�¶ȣ�CO2����������½�
C��NH3��ת����ʼ�յ���CO2��ת����
D��������Ч�Ĵ����ܹ���߰�������淋IJ���
�۰�������識���ˮ���̼��泥���������ˮ������ף�����������立�ĩ����1L0.1mol/L��������Һ��ֱ��pH=7�������£�������Һ����仯��������ȥ0.052mol��������泥���ʱ��Һ�м�������̼Ԫ�أ�
��ʱ��Һ��c��NH4+��=0.1mol/L��
NH4+ˮ��ƽ�ⳣ��ֵΪ4��10-9��
��3����ѧ�������о����ض���ȼ�ϵ�أ���ҺҲ�ܷ��磡�����ֵ��ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ���ܷ��磮����ȼ�ϵ�ؽṹ��ͼ2��ʾ��д���õ�صĸ�����Ӧʽ��CO��NH2��2+H2O-6e-=CO2+N2+6H+��
13��һ�ֻ�������ȼ�ϵ��ԭ����Ƶľƾ�����ǣ���ط�Ӧ�Ļ�ѧ����ʽΪ��CH3CH2OH+O2=CH3COOH+H2O�������й�˵������ȷ���ǣ�������
| A�� | ���ʱ���������Һ�е�H+�������ƶ� | |
| B�� | ���� 0.4 mol����ת�ƣ������� 2.24 L���� | |
| C�� | �����Ϸ�����ԭ��Ӧ�������Ϸ���������Ӧ | |
| D�� | �����ϵķ�ӦΪ��CH3CH2OH-4e-+H2O�TCH3COOH+4H+ |
11��CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ���������ֵ���ߵĻ�ѧƷ�� ��1��250��ʱ�������Ͻ�Ϊ��������4L�ܱ�������ͨ��6molCO2��4molCH4��������Ӧ��CO2��g��+CH4��g��?2CO��g��+2H2��g����ƽ����ϵ�и���ֵ�Ũ��Ϊ��
���ڸ������´�ƽ��ʱ��CH4��ת����Ϊ50%
����֪��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3kJ•mol-1
CO��g��+H2O��g��=CO2��g��+H2��g����H=+2.8kJ•mol-1
2CO��g��+O2��g��=2CO2��g����H=-566.0kJ•mol-1
��ӦCO2��g��+CH4��g��?2CO��g��+2H2��g���ġ�H=247.3KJkJ•mol-1
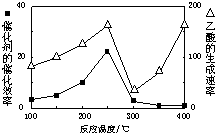
��2����Cu2Al2O4��������һ�������·�����Ӧ��CO2+CH4?CH3COOH�¶�������Ĵ�Ч�ʺ�������������ʣ���ͼ1������ش��������⣺
��250-300��ʱ���¶����߶�������������ʽ��͵�ԭ�����¶���250��300��ʱ�������Ĵ�Ч�ʽ���
��Ϊ���������ӦCH4��ת���ʣ��ɲ�ȡ�Ĵ�ʩ������Ӧѹǿ������CO2��Ũ�ȣ�д2����
��3��Li4SiO4���������ա��ͷ�CO2��ԭ���ǣ�500��ʱ��CO2��Li4SiO4�Ӵ�����Li2CO3��ƽ��������700�棬��Ӧ������У��ų�CO2��Li4SiO4����������ԭ���û�ѧ����ʽ��ʾ����ע������������淴Ӧ�������������CO2+Li4SiO4$?_{700��}^{500��}$Li2CO3+Li2SiO3
��4�������������ڽ����ơ�������Ͷ����ƣ�Na2Sx���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ������ͼ2����ʾ��
�ٸ����±����ݣ������жϸõ�ع����������¶�Ӧ������c��Χ�ڣ�����ĸ��ţ���
a.100������ b.100��-300��
c.300��-350��d.350��-2050��
�ڷŵ�ʱ���缫AΪ������
�۳��ʱ���ܷ�ӦΪNa2Sx=2Na+xS��3��x��5�����������ĵ缫��ӦʽΪSx2--2e-=xS
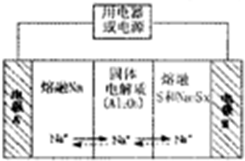
ͼ1 ͼ2��
| ���� | CH4 | CO2 | CO | H2 |
| ƽ��Ũ�ȣ�mol•L-1�� | 0.5 | 1.0 | 1.0 | 1.0 |
����֪��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3kJ•mol-1
CO��g��+H2O��g��=CO2��g��+H2��g����H=+2.8kJ•mol-1
2CO��g��+O2��g��=2CO2��g����H=-566.0kJ•mol-1
��ӦCO2��g��+CH4��g��?2CO��g��+2H2��g���ġ�H=247.3KJkJ•mol-1
��2����Cu2Al2O4��������һ�������·�����Ӧ��CO2+CH4?CH3COOH�¶�������Ĵ�Ч�ʺ�������������ʣ���ͼ1������ش��������⣺
��250-300��ʱ���¶����߶�������������ʽ��͵�ԭ�����¶���250��300��ʱ�������Ĵ�Ч�ʽ���
��Ϊ���������ӦCH4��ת���ʣ��ɲ�ȡ�Ĵ�ʩ������Ӧѹǿ������CO2��Ũ�ȣ�д2����
��3��Li4SiO4���������ա��ͷ�CO2��ԭ���ǣ�500��ʱ��CO2��Li4SiO4�Ӵ�����Li2CO3��ƽ��������700�棬��Ӧ������У��ų�CO2��Li4SiO4����������ԭ���û�ѧ����ʽ��ʾ����ע������������淴Ӧ�������������CO2+Li4SiO4$?_{700��}^{500��}$Li2CO3+Li2SiO3
��4�������������ڽ����ơ�������Ͷ����ƣ�Na2Sx���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ������ͼ2����ʾ��
�ٸ����±����ݣ������жϸõ�ع����������¶�Ӧ������c��Χ�ڣ�����ĸ��ţ���
| ���� | Na | S | Al2O3 |
| �۵�/�� | 97.8 | 115 | 2050 |
| �е�/�� | 892 | 444.6 | 2980 |
c.300��-350��d.350��-2050��
�ڷŵ�ʱ���缫AΪ������
�۳��ʱ���ܷ�ӦΪNa2Sx=2Na+xS��3��x��5�����������ĵ缫��ӦʽΪSx2--2e-=xS


ͼ1 ͼ2��