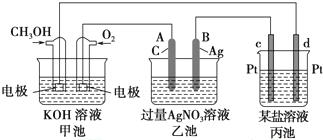
题目内容
20.某学生将氯乙烷与NaOH溶液共热几分钟后,冷却,滴入AgNO3溶液,结果未见到有白色沉淀生成,其主要原因是 ( )| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
分析 氯乙烷中的氯元素不是以离子状态存在的,因此不能与AgNO3溶液直接反应,必须使之变为Cl-,反应后溶液显碱性,不能直接加AgNO3溶液,否则Ag+与OH-反应得到Ag2O黑色沉淀,影响氯的检验.
解答 解:氯乙烷中的氯元素不是以离子状态存在的,因此不能与AgNO3溶液直接反应,必须使之变为Cl-.因此,应通过氯乙烷在碱性溶液中水解得到,但要注意,反应后溶液显碱性,不能直接加AgNO3溶液,否则Ag+与OH-反应得到Ag2O黑色沉淀,影响氯的检验,所以应加入足量硝酸酸化后,再加AgNO3溶液检验.
故选C.
点评 本题考查氯离子的检验,为高频考点,侧重于学生的分析、实验能力的考查,题目难度中等,注意碱性条件下生成的AgOH不稳定,易分解生成Ag2O黑色沉淀而影响实验现象.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应可以制造价值更高的化学品. (1)250℃时,以镍合金为催化剂,向4L密闭容器中通入6molCO2、4molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分的浓度为:
①在该条件下达平衡时,CH4的转化率为50%
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
求反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3KJkJ•mol-1
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4?CH3COOH温度与催化剂的催化效率和乙酸的生成速率(如图1).请回答下列问题:
①250-300℃时,温度升高而乙酸的生成速率降低的原因是温度在250~300℃时,催化剂的催化效率降低
②为提高上述反应CH4的转化率,可采取的措施有增大反应压强、增大CO2的浓度(写2条)
(3)Li4SiO4可用于吸收、释放CO2,原理是:500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反方向和逆反应方向的条件):CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理(如图2)所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
a.100℃以下 b.100℃-300℃
c.300℃-350℃d.350℃-2050℃
②放电时,电极A为负极.
③充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS
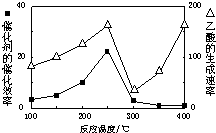
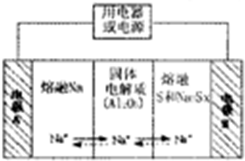
图1 图2.
| 物质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol•L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
求反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3KJkJ•mol-1
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4?CH3COOH温度与催化剂的催化效率和乙酸的生成速率(如图1).请回答下列问题:
①250-300℃时,温度升高而乙酸的生成速率降低的原因是温度在250~300℃时,催化剂的催化效率降低
②为提高上述反应CH4的转化率,可采取的措施有增大反应压强、增大CO2的浓度(写2条)
(3)Li4SiO4可用于吸收、释放CO2,原理是:500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反方向和逆反应方向的条件):CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理(如图2)所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
c.300℃-350℃d.350℃-2050℃
②放电时,电极A为负极.
③充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS


图1 图2.
8.在电治铝的电解槽中存在电解质W2[X2Y2Z4],己知四种元素的简单离子的电子层结构均相同,Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半,下列说法正确的是( )
| A. | 原子序数:W>X>Y>Z | |
| B. | 原子半径:W>X>Y>Z | |
| C. | W的最高价氧化物的水化物碱性比X的弱 | |
| D. | Y的简单氢化物的稳定性比Z的强 |
15.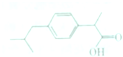 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O3 | |
| B. | 布洛芬与苯甲酸(C6H5COOH)互为同系物 | |
| C. | 布洛芬能发生加成、取代等反应 | |
| D. | 丁苯丙酸共有12种可能的结构 |
5.硼烷氨的化学式为H6NB,它是乙烷的等电子体,结构与乙烷类似.硼烷氨是最基本的硼氨化合物,因为氢经济的发展,硼烷氨因其稳定的储氢能力引起人们关注.下列有关硼烷氨的说法中正确的是( )
| A. | 原子半径:B<N | |
| B. | 硼烷氨分子与乙烷分子结构相似,分子内既含有极性共价键又含有非极性共价键 | |
| C. | 硼烷氨分子中的每个原子均达到最外层8电子稳定结构 | |
| D. | 硼烷氨分子中所有的H原子不可能在同一个平面内 |
12.下列化合物的同分异构体数目与C3H8O的同分异构体数目相同的是( )
| A. | C3H6 | B. | C5H12 | C. | C6H4Cl2 | D. | C4H8 |
9.K2Fe04是一种既能杀菌消毒,豕能聚凝净水的水处理剂,工业上制备该物质的反应为:Fe(OH)3+C1O-+OH-→FeO42-+Cl-+H20 (未配平),则下列有关说法正确的是( )
| A. | 该物质作净水处理剂与Cl2的作用原理完全相同 | |
| B. | 该反应表明碱性条件下ClO-氧化性强于FeO42- | |
| C. | 上述反应中Fe(0H)3与ClO-的物质的量之比应为3:2 | |
| D. | 因为FeO32-可直接水解生成氢氧化铁胶体,故可做自来水的聚凝剂 |
15.核电荷数为1~18的元素中,下列叙述正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 核电荷数为17的元素的原子的质量数一定是35 |