题目内容
3.用括号中的试剂除去各组物质中的少量杂质正确的是( )| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
分析 A.苯和甲苯、溴互相溶解;
B.乙烯的量不能确定,易引入新杂质;
C.生成的碘易溶于溴苯;
D.水和CaO反应而被吸收,利于蒸馏.
解答 解:A.苯和甲苯、溴互相溶解,不能分离,应用高锰酸钾、氢氧化钠溶液除杂,故A错误;
B.乙烯的量不能确定,易引入新杂质,可用溴水除杂,故B错误;
C.生成的碘易溶于溴苯,应用氢氧化钠溶液除杂,故C错误;
D.水和CaO反应而被吸收,利于蒸馏,故D正确.
故选D.
点评 本题综合考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新的杂质,更不能影响被提纯物质的性质,难度不大.

练习册系列答案
相关题目
13.一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O.下列有关说法不正确的是( )
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有 0.4 mol电子转移,则消耗 2.24 L氧气 | |
| C. | 正极上发生还原反应,负极上发生氧化反应 | |
| D. | 负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+ |
11.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应可以制造价值更高的化学品. (1)250℃时,以镍合金为催化剂,向4L密闭容器中通入6molCO2、4molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分的浓度为:
①在该条件下达平衡时,CH4的转化率为50%
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
求反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3KJkJ•mol-1
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4?CH3COOH温度与催化剂的催化效率和乙酸的生成速率(如图1).请回答下列问题:
①250-300℃时,温度升高而乙酸的生成速率降低的原因是温度在250~300℃时,催化剂的催化效率降低
②为提高上述反应CH4的转化率,可采取的措施有增大反应压强、增大CO2的浓度(写2条)
(3)Li4SiO4可用于吸收、释放CO2,原理是:500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反方向和逆反应方向的条件):CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理(如图2)所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
a.100℃以下 b.100℃-300℃
c.300℃-350℃d.350℃-2050℃
②放电时,电极A为负极.
③充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS
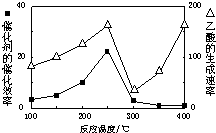
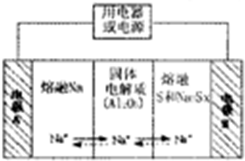
图1 图2.
| 物质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol•L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
求反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3KJkJ•mol-1
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4?CH3COOH温度与催化剂的催化效率和乙酸的生成速率(如图1).请回答下列问题:
①250-300℃时,温度升高而乙酸的生成速率降低的原因是温度在250~300℃时,催化剂的催化效率降低
②为提高上述反应CH4的转化率,可采取的措施有增大反应压强、增大CO2的浓度(写2条)
(3)Li4SiO4可用于吸收、释放CO2,原理是:500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反方向和逆反应方向的条件):CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理(如图2)所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
c.300℃-350℃d.350℃-2050℃
②放电时,电极A为负极.
③充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS


图1 图2.
18.在体积为1L的密闭容器中,某反应A(?)+2B(?)?2C(g)达到平衡后,测得C的物质的量浓度为1 mol•L-1,在恒温条件下,将体积扩大到1.5L后,测得平衡状态下C的浓度0.75mol•L-1.则有关说法正确的是( )
| A. | A、B均为气体,平衡逆向移动 | B. | A为气体,平衡正向移动 | ||
| C. | B为气体,平衡不移动 | D. | A、B都不是气体,平衡正向移动 |
8.在电治铝的电解槽中存在电解质W2[X2Y2Z4],己知四种元素的简单离子的电子层结构均相同,Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半,下列说法正确的是( )
| A. | 原子序数:W>X>Y>Z | |
| B. | 原子半径:W>X>Y>Z | |
| C. | W的最高价氧化物的水化物碱性比X的弱 | |
| D. | Y的简单氢化物的稳定性比Z的强 |
15.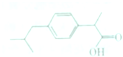 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O3 | |
| B. | 布洛芬与苯甲酸(C6H5COOH)互为同系物 | |
| C. | 布洛芬能发生加成、取代等反应 | |
| D. | 丁苯丙酸共有12种可能的结构 |
12.下列化合物的同分异构体数目与C3H8O的同分异构体数目相同的是( )
| A. | C3H6 | B. | C5H12 | C. | C6H4Cl2 | D. | C4H8 |