题目内容
6. A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:回答下列问题
| 元素 | 相关信息 |
| A | 元素A是周期表中原子半径最小的元素 |
| B | B的单质由双原子分子构成,分子中有14个电子 |
| C | C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌 |
| D | D是前四周期元素中第一电离能最小的元素 |
| E | E位于ds区且原子的最外层电子数与A相同 |
(1)C元素基态原子的价电子排布图为

(2)[E(A2C)4]2+中E2+与A2C间的作用为B(填字母编号
A.离子键 B.配位键 C.金属键 D.分子间作用力
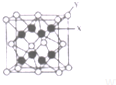
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则X应为K+
D2C的熔点比CaF2的熔点低(填“高”、“低”、“无法比较”)
(4)与B2C互为等电子体分子为CO2,其分子的立体构型为直线型
(5)已知:A2(g)+$\frac{1}{2}$C2(g)=A2C(g)△H1=-akJ/mol
B2(g)+3A2(g)=2BA3(g)△H2=-bkJ/mol
则34gBA3(g)与C2(g)反应生成B2(g)与A2C(g)时,该反应的热化学反应方程式为2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol.
分析 A~E五种元素均位于周期表的前四周期,元素A是周期表中原子半径最小的元素,则A为H元素;B的单质由双原子分子构成,分子中有14个电子,B原子核外电子数为7,故B为N元素;C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌,则C为O元素;D是前四周期元素中第一电离能最小的元素,则D为K元素;E位于ds区且原子的最外层电子数与A相同,外围电子排布为3d104s1,故E为Cu,据此解答.
解答 解:A~E五种元素均位于周期表的前四周期,元素A是周期表中原子半径最小的元素,则A为H元素;B的单质由双原子分子构成,分子中有14个电子,B原子核外电子数为7,故B为N元素;C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌,则C为O元素;D是前四周期元素中第一电离能最小的元素,则D为K元素;E位于ds区且原子的最外层电子数与A相同,外围电子排布为3d104s1,故E为Cu.
(1)C为O元素,原子核外电子数为8,核外电子排布式1s22s22p4,元素基态原子的价电子排布图为  ,故答案为:
,故答案为: ;
;
(2)[Cu(H2O)4]2+中Cu2+与H2O间的作用为配位键,故选:B;
(3)K2O的晶胞结构与CaF2晶胞(如图)相似,晶胞中X原子数目为8,Y原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,X、Y原子数目之比为2:1,故X为K+;
Ca2+、O2-离子电荷相同,K+、F-离子电荷相同,由于K+离子半径大于Ca2+,O2-离子半径大于F-,故CaF2的晶格能更大,K2O的熔点比CaF2的熔点低,
故答案为:K+;低;
(4)与N2O互为等电子体为CO2,其分子的立体构型为直线型,
故答案为:CO2;直线型;
(5)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-akJ/mol
②N2(g)+3H2(g)=2NH3(g)△H2=-bkJ/mol
则34gNH3(g)的物质的量为$\frac{34g}{17g/mol}$=2mol,
根据盖斯定律,①×3-②得:2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol,
故答案为:2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol.
点评 本题是对物质结构的考查,涉及核外电子排布、配位键、晶胞计算、晶体类型与性质、等电子体、热化学方程式书写,(5)为易错点,学生容易忽略氨气量问题.

| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| D. | 0.1mol/L的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数(Ka) | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | PH相同的氯水和亚硝酸溶液,水电离出的c(H+)相同 | |
| B. | 往氯水滴加NaOH溶液呈中性:c(Na+)=2(ClO-)+c(HClO) | |
| C. | 浓度相等的CH3COONa和NaNO2两份溶液中;c(CH3COO)->c(NO${\;}_{2}^{-}$) | |
| D. | 向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能 |
| 选项 | 物质或离子 | 能否共存 | 原因解释 |
| A | 常温常压下:NH3、O3、H2、HCl | 不能共存 | NH3为碱性气体,HCl为酸性气体,发生的反应为:NH3+HCl=NH4Cl |
| B | 水溶液中:K+、Ag+、NO3-、NH3•H2O | 不能共存 | 发生反应的离子方程式为:Ag++OH-=AgOH↓ |
| C | 水电离出的c(OH-)=1×10-13mol/L的溶液中:Fe2+、MnO4-、SO42-、Na+ | 不能共存 | 只可能发生反应:Fe2++2OH-=Fe(OH)2↓ |
| D | 溶液中:Al3+、Na+、SO42-、CO32- | 可以共存 | 不能发生反应 |
| A. | A | B. | B | C. | C | D. | D |
| 物质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol•L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
求反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3KJkJ•mol-1
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4?CH3COOH温度与催化剂的催化效率和乙酸的生成速率(如图1).请回答下列问题:
①250-300℃时,温度升高而乙酸的生成速率降低的原因是温度在250~300℃时,催化剂的催化效率降低
②为提高上述反应CH4的转化率,可采取的措施有增大反应压强、增大CO2的浓度(写2条)
(3)Li4SiO4可用于吸收、释放CO2,原理是:500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反方向和逆反应方向的条件):CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理(如图2)所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
c.300℃-350℃d.350℃-2050℃
②放电时,电极A为负极.
③充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS
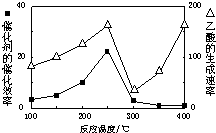
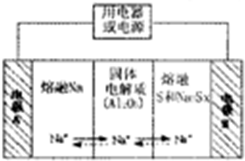
图1 图2.
| A. | A、B均为气体,平衡逆向移动 | B. | A为气体,平衡正向移动 | ||
| C. | B为气体,平衡不移动 | D. | A、B都不是气体,平衡正向移动 |
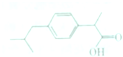 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O3 | |
| B. | 布洛芬与苯甲酸(C6H5COOH)互为同系物 | |
| C. | 布洛芬能发生加成、取代等反应 | |
| D. | 丁苯丙酸共有12种可能的结构 |