题目内容
9.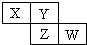 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X<Z<W | |
| B. | 气态氢化物的稳定性:X>Y | |
| C. | 非金属性:Z>Y | |
| D. | 最高价氧化物对应水化物的酸性:W>Z |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则内层电子数为2,最外层电子数为6,即Y为O,由元素在周期表中的位置可知,X为N,Z为S,W为Cl,然后利用元素及其单质、化合物的性质来解答.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则内层电子数为2,最外层电子数为6,即Y为O,由元素在周期表中的位置可知,X为N,Z为S,W为Cl,
A.电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径为Z>W>X>Y,故A错误;
B.同周期元素从左到右元素的非金属性逐渐增大,Y的氢化物的稳定性较强,故B错误;
C.同主族元素从上到下元素的非金属性逐渐减弱,Y的非金属性较强,故C错误;
D.非金属性越强,最高价氧化物的水化物酸性越强,则非金属性W>Z,最高价氧化物的水化物酸性W较Z强,故D正确.
故选D.
点评 本题考查位置、结构、性质的关系,明确元素在周期表中的位置及元素周期律是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
19.下表中是一些化学键键能的数据
根据上述数据回答(1)~(3)题
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表卤族原子)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是F2.
| 化学键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表卤族原子)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是F2.
4.既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是( )
| A. | 在导管口处点燃 | B. | 通入足量高锰酸钾溶液中 | ||
| C. | 通入足量溴水中 | D. | 在一定条件下与H2反应 |
14.将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO 4═Fe2O3+SO2↑+SO3↑. 如将生成的混合气体通过BaCl2溶液,应发生的现象有( )
| A. | 一定产生BaSO4沉淀 | B. | 一定产生BaSO3沉淀 | ||
| C. | 一定没有SO2逸出 | D. | 一定有SO3逸出 |
1.如图所示装置中,发生反应的离子方程式为Cu+2H+═Cu2++H2↑,下列说法正确的是( )
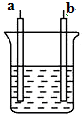

| A. | a、b不可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀H2SO4 | |
| C. | 该装置可能是原电池,电解质溶液为稀HNO3 | |
| D. | 反应一段时间后,断开电路,向溶液中通入H2可使溶液复原 |
18.下列关于氯气的说法错误的是( )
| A. | 无色无味 | B. | 有毒 | C. | 密度比空气大 | D. | 单质 |
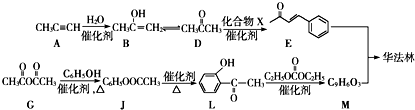

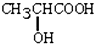 .问:
.问: