题目内容
1.如图所示装置中,发生反应的离子方程式为Cu+2H+═Cu2++H2↑,下列说法正确的是( )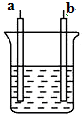
| A. | a、b不可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀H2SO4 | |
| C. | 该装置可能是原电池,电解质溶液为稀HNO3 | |
| D. | 反应一段时间后,断开电路,向溶液中通入H2可使溶液复原 |
分析 铜和弱氧化性酸不反应,要使该反应Cu+2H+=Cu2++H2↑发生,则要将该装置设计成电解池,且铜作阳极,电解质为酸或活泼金属的含氧酸盐或可溶性的强碱.
解答 解:铜和弱氧化性酸不反应,要使该反应Cu+2H+=Cu2++H2↑发生,则要将该装置设计成电解池,且铜作阳极,电解质为酸或活泼金属的含氧酸盐或可溶性的强碱.
A.该装置是电解池,a、b材料可能是同种材料,故A错误;
B.该装置应该设计成电解池,阴极上氢离子放电,所以电解质溶液可以为稀H2SO4,故B正确;
C.硝酸和铜反应生成氮氧化物而不生成氢气,故C错误;
D.反应一段时间后,断开电路,向溶液中通入H2不发生反应,故D错误;
故选B.
点评 本题考查了原电池和电解池原理,根据电池反应式是否自发进行确定为哪种类型的电池,再结合电解池反应来分析解答,知道离子的放电顺序,注意:活泼金属作电解池阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 乙烯的结构简式可以表示为CH2CH2 | |
| B. | 苯、乙醇和乙酸都能发生取代反应 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 乙酸不能与NaHCO3溶液反应生成CO2 |
12.某烃可以用通式CnH2n来表示,下列有关此烃的说法正确的是( )
| A. | 分子中有C=C双键 | B. | 分子中没有C=C双键 | ||
| C. | 分子可能有C=C双键 | D. | 分子中可能只含单键 |
9.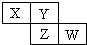 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X<Z<W | |
| B. | 气态氢化物的稳定性:X>Y | |
| C. | 非金属性:Z>Y | |
| D. | 最高价氧化物对应水化物的酸性:W>Z |
16.下列化学用语表示正确的是( )
| A. | CS2的比例模型: | |
| B. | H2O2的电子式: | |
| C. | 氯离子(Cl-)的结构示意图: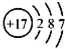 | |
| D. | 基态镁原子的电子排布图:1s22s22p63s2 |
6.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同)
a.容器中的压强不变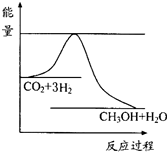
b.1mol H-H键断裂的同时断裂2mol H-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数
①实验1中以υ(CO2)表示的反应速率为0.16mol•(L•min)-1.
②该反应的逆反应为吸(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同)
a.容器中的压强不变

b.1mol H-H键断裂的同时断裂2mol H-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为吸(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
13.下列属于电解质并能导电的物质是( )
| A. | 液态HCl | B. | 熔融的NaOH | C. | KNO3溶液 | D. | FeCl3晶体 |
10.如图所示,电极a和b均为石墨棒,在电解过程中,下列说法正确的是( )
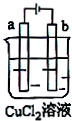

| A. | 电极a表面呈红色 | |
| B. | 电极b作阳极 | |
| C. | 电子由电源的正极沿导线流向电极a | |
| D. | 该装置能量转化形式为电能转化为化学能 |
11.等质量的下列物质分别完全燃烧,生成CO2的量最多的是( )
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C2H6O |