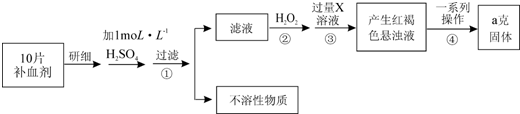
题目内容
18.下列关于氯气的说法错误的是( )| A. | 无色无味 | B. | 有毒 | C. | 密度比空气大 | D. | 单质 |
分析 A、氯气为黄绿色有刺激性气味的气体;
B、氯气为黄绿色有刺激性气味的有毒气体;
C、氯气的相对分子质量为17大于空气平均相对分子质量29;
D、氯气是由同种元素形成的单质.
解答 解:A、氯气为黄绿色有刺激性气味的气体,故A错误;
B、氯气为黄绿色有刺激性气味的有毒气体,故B正确;
C、氯气的相对分子质量为17大于空气平均相对分子质量29,所以氯气的密度比空气大,故C正确;
D、氯气是由同种元素形成的单质,故D正确;
故选A.
点评 本题考查氯气的性质,为元素化合物知识的高频考点,有利于培养学生的良好的科学素养和学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
9.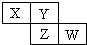 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X<Z<W | |
| B. | 气态氢化物的稳定性:X>Y | |
| C. | 非金属性:Z>Y | |
| D. | 最高价氧化物对应水化物的酸性:W>Z |
6.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同)
a.容器中的压强不变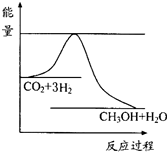
b.1mol H-H键断裂的同时断裂2mol H-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数
①实验1中以υ(CO2)表示的反应速率为0.16mol•(L•min)-1.
②该反应的逆反应为吸(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同)
a.容器中的压强不变

b.1mol H-H键断裂的同时断裂2mol H-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为吸(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
13.下列属于电解质并能导电的物质是( )
| A. | 液态HCl | B. | 熔融的NaOH | C. | KNO3溶液 | D. | FeCl3晶体 |
3.硫与热的烧碱溶液反应的化学方程式为3S+6NaOH═2Na2S+Na2SO3+3H2O,下列有关叙述正确的是( )
| A. | S是氧化剂,NaOH是还原剂 | |
| B. | Na2S是还原产物,H2O是氧化产物 | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 氧化剂与还原剂的物质的量之比为2:1 |
10.如图所示,电极a和b均为石墨棒,在电解过程中,下列说法正确的是( )
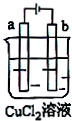

| A. | 电极a表面呈红色 | |
| B. | 电极b作阳极 | |
| C. | 电子由电源的正极沿导线流向电极a | |
| D. | 该装置能量转化形式为电能转化为化学能 |
8.能正确表示下列反应的离子方程式是( )
| A. | Cl2与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | H2SO4与Ba(OH)2反应:Ba2++SO42-═BaSO4 | |
| C. | 铁溶于足量的稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |