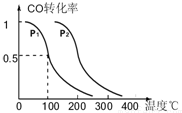
题目内容
14.将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO 4═Fe2O3+SO2↑+SO3↑. 如将生成的混合气体通过BaCl2溶液,应发生的现象有( )| A. | 一定产生BaSO4沉淀 | B. | 一定产生BaSO3沉淀 | ||
| C. | 一定没有SO2逸出 | D. | 一定有SO3逸出 |
分析 混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,注意H2SO3酸性小于HCl,据此分析解答.
解答 解:混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,则没有SO3逸出;
H2SO4+BaCl2=BaSO4↓+2HCl,则有BaSO4沉淀生成;
由于H2SO3酸性小于HCl和H2SO4,则SO2不能与BaCl2溶液反应而从溶液中逸出,故得不到BaSO3沉淀,
故选A.
点评 本题考查二氧化硫、三氧化硫性质,注意二氧化硫和三氧化硫性质区别是解本题关键,注意:二氧化硫和氯化钡溶液不反应,但二氧化硫和硝酸钡溶液反应生成白色沉淀,为易错点.

练习册系列答案
相关题目
5.下列物质中,不能发生消去反应的是( )
| A. | 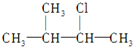 | B. | CH2BrCH2Br | ||
| C. | 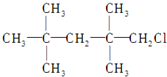 | D. | CH2ClCH2CH3 |
2.某气态烃0.5mol能与1molHCl完全加成,加成后产物分子上的氢原子又可被3molCl2取代,则此气态烃可能是
( )
( )
| A. | CH≡CH | B. | CH≡C-CH3 | C. | CH2═CH2 | D. | CH2═C(CH3)CH3 |
9.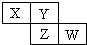 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X<Z<W | |
| B. | 气态氢化物的稳定性:X>Y | |
| C. | 非金属性:Z>Y | |
| D. | 最高价氧化物对应水化物的酸性:W>Z |
19.普伐他汀是一种调节血脂的药物,其结构如图,下列关于普伐他汀的性质描述正确的是( )


| A. | 不能通过自身反应形成高分子化合物 | |
| B. | 不能使酸性KMnO4溶液褪色 | |
| C. | 能发生加成、取代、消去、氧化反应 | |
| D. | 1 mol该物质最多可与4 mol NaOH反应 |
6.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同)
a.容器中的压强不变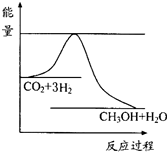
b.1mol H-H键断裂的同时断裂2mol H-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数
①实验1中以υ(CO2)表示的反应速率为0.16mol•(L•min)-1.
②该反应的逆反应为吸(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同)
a.容器中的压强不变

b.1mol H-H键断裂的同时断裂2mol H-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为吸(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
3.硫与热的烧碱溶液反应的化学方程式为3S+6NaOH═2Na2S+Na2SO3+3H2O,下列有关叙述正确的是( )
| A. | S是氧化剂,NaOH是还原剂 | |
| B. | Na2S是还原产物,H2O是氧化产物 | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 氧化剂与还原剂的物质的量之比为2:1 |