题目内容
【题目】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
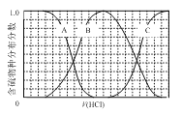
(1)含硫物种B表示__________(填离子符号)。
(2)在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为_____________(填选字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
【答案】HS- c
【解析】
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合图1所示H2S、HS-、S2-的分布分数进行解答;NaHS的含量先增加后减少;根据物料守恒可求得滴加过程中,溶液中微粒浓度大小关系。
(1)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小为S2-,B先增加后减少为HS-,C浓度一直在增加为H2S,故答案为:HS-;
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)];溶液中存在电荷守恒得到c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+),故答案为:c。

 习题精选系列答案
习题精选系列答案【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25 |
|
|
|
下列选项错误的是( )
A.CN + H2O + CO2 → HCN +HCO3﹣
B.2HCOOH + CO32﹣ → 2HCOO + H2O + CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者