题目内容
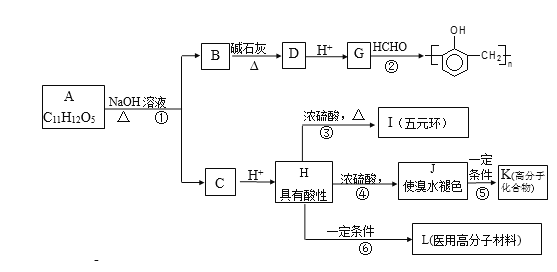
【题目】有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构。试根据下图中各有机物的相互转化关系回答:
已知:① 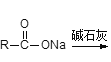 R-H;②
R-H;②![]() 。
。
完成下列填空:
(1)写出结构简式A___________________;L________________。
(2)上述物质中互为同分异构体的是_______________(填符号);
(3)上述变化中,属于缩聚反应的是_________;属于消去反应的是_______(均填反应编号)。
(4)物质B用盐酸酸化可得到产物W,写出一种既属于酚类、又属于酯类的的W的同分异构体______________________。
(5)反应③的产物除I之外,还有一些副产物,请写出其中2种类型不同的产物的结构简式____________________、____________________。
(6)设计一条从甲烷合成HCHO的合成路线。___________。
【答案】![]()
![]() I、J ②⑥ ④
I、J ②⑥ ④ ![]() CH2=CHCH2COOH; HOCH2CH2CH2COOCH2CH2CH2COOH CH4+Cl2
CH2=CHCH2COOH; HOCH2CH2CH2COOCH2CH2CH2COOH CH4+Cl2![]() CH2Cl2+2HCl、CH2Cl2+H2O
CH2Cl2+2HCl、CH2Cl2+H2O![]() HCHO+2HCl
HCHO+2HCl
【解析】
根据转化关系图知,G与甲醛得到酚醛树脂,可知G为![]() ,逆推可知D为
,逆推可知D为![]() ,有机物A的水溶液显酸性,遇FeC13溶液不显色,则A含有-COOH,不含酚羟基,苯环上的一氯代物只有两种,说明A的苯环上有2个不同的对位取代基,结合题目信息①中的脱羧反应,可知B的结构简式为
,有机物A的水溶液显酸性,遇FeC13溶液不显色,则A含有-COOH,不含酚羟基,苯环上的一氯代物只有两种,说明A的苯环上有2个不同的对位取代基,结合题目信息①中的脱羧反应,可知B的结构简式为![]() ,A中存在羧酸与酚形成的酯基,则C为羧酸纳盐,C酸化得到具有酸性,在浓硫酸、加热条件下可以得到J及I,是五元环状化合物,应是形成环酯,则H中还含有羟基,且羟基与羧基之间有3个碳原子,结合A的分子式可知,H为HOCH2CH2CH2COOH,逆推可知A为
,A中存在羧酸与酚形成的酯基,则C为羧酸纳盐,C酸化得到具有酸性,在浓硫酸、加热条件下可以得到J及I,是五元环状化合物,应是形成环酯,则H中还含有羟基,且羟基与羧基之间有3个碳原子,结合A的分子式可知,H为HOCH2CH2CH2COOH,逆推可知A为![]() ,C为HO(CH2)3COONa,顺推可知I为
,C为HO(CH2)3COONa,顺推可知I为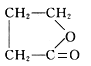 ,H通过酯化发生缩聚反应生成L为:
,H通过酯化发生缩聚反应生成L为:![]() ,H发生消去反应生成J为CH2=CHCH2COOH,J发生加聚反应生成K为
,H发生消去反应生成J为CH2=CHCH2COOH,J发生加聚反应生成K为 ,据此解答。
,据此解答。
(1)根据上述分析知,A为![]() ,L为
,L为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)上述物质中I为 ,J为CH2=CHCH2COOH,二者分子式相同,结构不同,互为同分异构体,故答案为:I、J;
,J为CH2=CHCH2COOH,二者分子式相同,结构不同,互为同分异构体,故答案为:I、J;
(3)上述变化中,反应②⑥生成高聚物,且有水生成,属于缩聚反应,反应④属于消去反应,故答案为:②⑥;④;
(4)物质B用盐酸酸化可得到产物w,则W为![]() ,W的同分异构体中,既属于酚类,同时也属于酯类,侧链为-OH、-OOCH,有邻、间、对三种,其中一种同分异构体的结构简式为
,W的同分异构体中,既属于酚类,同时也属于酯类,侧链为-OH、-OOCH,有邻、间、对三种,其中一种同分异构体的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)反应③的产物除I之外,还可能发生消去反应生成CH2=CHCH2COOH,也可以形成链状酯HOCH2CH2CH2COOCH2CH2CH2COOH等,故答案为:CH2=CHCH2COOH;HOCH2CH2CH2COOCH2CH2CH2COOH;
(6)上述反应中的HCHO可以用甲烷和必要的无机原料制备,有关反应的化学方程式为: CH4+Cl2![]() CH2Cl2+2HCl、CH2Cl2+H2O
CH2Cl2+2HCl、CH2Cl2+H2O![]() HCHO+2HCl,故答案为:CH4+Cl2
HCHO+2HCl,故答案为:CH4+Cl2![]() CH2Cl2+2HCl、CH2Cl2+H2O
CH2Cl2+2HCl、CH2Cl2+H2O![]() HCHO+2HCl。
HCHO+2HCl。

 阅读快车系列答案
阅读快车系列答案【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
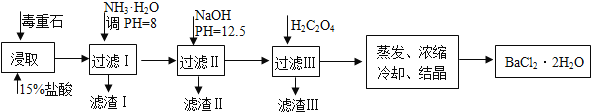
完成下列填空:
(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的____________________________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ 中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_________________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | _______ | 假设一成立 |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ________ |
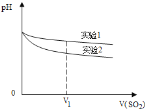
为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图。实验1中溶液pH变小的原因是____________;V1时,实验2中溶液pH小于实验1的原因是__________。(用离子方程式表示)
(2)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论:
实验步骤 | 实验现象 | 结论 |
__________________ | ______________ | 假设二成立 |
(3)若假设二成立,请预测:在相同条件下,分别用足量的O2和KNO3氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者_____________(填“大于”或“小于”)后者,理由是__________________________。