题目内容
【题目】图可设计成多种用途的电化学装置。下列分析正确的是
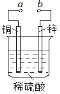
A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.当a和b用导线连接时,铜片上发生的反应为:2H++2e →H2↑
C.将a与电源正极相连可以保护锌片,叫牺牲阳极的阴极保护法
D.a和b用导线连接后,电路中通过0.02 mol电子时,产生0.02 mol气体
【答案】B
【解析】
A. a和b用导线连接,该装置是原电池,锌作负极,铜作正极,阳离子移向正极铜,阴离子移向负极锌,所以溶液中的SO42-向锌片附近移动,故A错误;
B. a和b用导线连接时,该装置是原电池,锌作负极,铜作正极,铜片上发生的反应为:2H++2e →H2↑,故B正确;
C. a与电源正极相连,该装置是电解池,则铜为阳极,锌为阴极,可以保护锌被腐蚀,这叫外接电源的阴极保护法,故C错误;
D. a和b用导线连接时,该装置是原电池,铜作正极,铜片上发生的反应为:2H++2e →H2↑,所以电路中通过0.02mol电子时,产生0.01mol气体,故D错误;
故选B。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
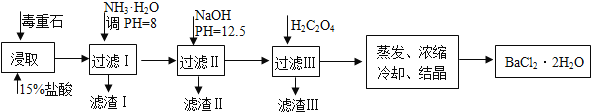
完成下列填空:
(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的____________________________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ 中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_________________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |