题目内容
19.MgSO4•7H2O医药上用作泻剂.工业上用氯碱工业中的一次盐泥为原料生产.已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分.主要工艺如下:
(1)用硫酸调整溶液pH到1~2,硫酸的作用是浸出Mg、Fe、Al、Mn离子,除去Si、Ca.
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是Al(OH)3、Fe(OH)3 (写化学式).其中次氯酸钠溶液将MnSO4在碱性条件下转化为MnO2的离子方程式为:Mn2++2OH-+C1O-=MnO2↓+Cl-+H2O.
(3)若除杂后过滤,发现滤液发黄,需采取的措施是添加适量的次氯酸钠溶液,再煮沸、过滤.
(4)过滤后晶体常用丙酮或乙醇代替蒸馏水洗涤的目的是减小硫酸镁的溶解损耗,并快速干燥.
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4•7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时.为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→称量后重复脱水→冷却→称量至恒重.
分析 一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分,加入硫酸反应生成硫酸镁,硫酸钙,硫酸铁,硫酸铝,硫酸锰,会把碳酸盐和硅酸盐转化为溶于水的硫酸盐,调节溶液PH至1~2,把钙离子形成硫酸钙沉淀,把硅酸根离子形成硅酸沉淀过滤除去,过滤,滤渣为H2SiO3、CaSO4,滤液加入次氯酸钠是为了氧化锰离子为二氧化锰,调节溶液PH,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,将滤液经过加热浓缩,冷却结晶,过滤等操作,获得MgSO4•7H2O晶体.
(1)将盐泥中的碳酸盐、硅酸盐转化为硫酸盐,硅酸盐转化为硅酸沉淀,钙盐转化为硫酸钙沉淀而除去;
(2)加热煮沸的主要目的是促进Al3+、Fe3+水解及Mn2+氧化成MnO2;
(3)滤液发黄可能含有三价铁离子;
(4)丙酮为有机物,易挥发;
(5)重复脱水后恒重说明已经完全脱水.
解答 解:(1)盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分,用H2SO4调节溶液PH至1~2,会把碳酸盐和硅酸盐转化为溶于水的硫酸盐,把钙离子形成硫酸钙沉淀,把硅酸根离子形成硅酸沉淀过滤除去,
故答案为:浸出Mg、Fe、Al、Mn离子,除去Si、Ca;
(2)Al3+、Fe3+水解生成Al(OH)3、Fe(OH)3,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++2OH-+C1O-=MnO2↓+Cl-+H2O,
故答案为:Al(OH)3、Fe(OH)3;Mn2++2OH-+C1O-=MnO2↓+Cl一+H2O;
(3)滤液发黄可能含有三价铁离子,可添加适量的次氯酸钠溶液,Fe3++3H2O?Fe(OH)3+3H+,次氯酸钠显碱性,可促进三价铁离子的水解,再煮沸、过滤,
故答案为:添加适量的次氯酸钠溶液,再煮沸、过滤;
(4)丙酮为有机物易挥发,用丙酮代替蒸馏水洗涤可减小硫酸镁的溶解损耗,并快速干燥,
故答案为:减小硫酸镁的溶解损耗,并快速干燥;
(5)重复脱水后至恒重说明已经完全脱水,
故答案为:称量后重复脱水→冷却→称量至恒重.
点评 本题考查物质的制备、除杂,涉及物质的检验以及沉淀的转化等知识,题目较为综合,难度中等,考查学生的分析能力.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 蒸发氯化钠溶液时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏石油时,应使温度计水银球插入液面以下 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口放到另一个烧杯 | |
| D. | 检验硫酸根离子的操作是先加硝酸酸化再加入氯化钡溶液 |

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取滤液C少量于试管中,滴加几滴KSCN溶液,若溶液变为血红色,证明滤液C中的Fe3+离子未除尽,反之已除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒.需要在氯化氢气流中蒸干制取无水氯化铜的原因是HCl抑制CuCl2水解.
(4)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol?L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).
| A. | 食醋中含有3-5%的乙酸 | B. | 乙酸可被催化氧化成乙醛 | ||
| C. | 可用乙酸清除水壶中的水垢 | D. | 乙酸分子的官能团是-COOH |
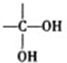 这个结构不稳定,自动脱水,生成碳基.
这个结构不稳定,自动脱水,生成碳基.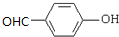 ;有机物C的系统名称为:2-甲基丙醛.
;有机物C的系统名称为:2-甲基丙醛.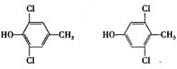 .
.