题目内容
20.请写出以下物质的电子式:MgCl2

NaOH

H2O2

CO2

NH3
 .
.
分析 氯化镁为离子化合物,必须标出阴阳离子的电子式;
NaOH是由钠离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合;
双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
氨气为共价化合物,分子中存在3个氮氢键,氮原子最外层为8个电子.
解答 解:氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ;
;
NaOH是由钠离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合,其电子式为 ,
,
双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ;
;
二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ;
;
NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为 ,
,
故答案为: ;
; ;
; ;
; ;
; .
.
点评 本题考查了电子式的书写及其应用,题目难度中等,注意电子式的概念及书写方法,明确离子化合物与共价化合物电子式的区别,试题培养了学生规范答题的能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
10.下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是( )
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | Cl2+H2O?HC1+HC1O | D. | Na2CO3+BaC12=BaCO3↓+2NaC1 |
11.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | HBrO4的酸性比HClO4的酸性强 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是无色、有毒且无硫化氢稳定的气体 |
8.有A、B、C、D四种金属,分别把它们加入到稀盐酸中,A、B、D反应后有气体放出,C无明显现象,再把A、D加入B盐溶液中,D表面有B析出,而A没有,则四种金属的活动性顺序是为( )
| A. | A>B>D>C | B. | B>D>A>C | C. | D>B>A>C | D. | D>A>B>C |
12.海带中碘元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
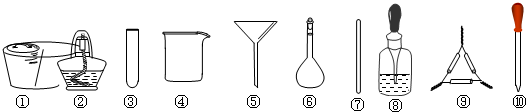

| A. | 将干海带剪碎后灼烧灰化,选用①、②和⑨ | |
| B. | 将海带灰加入蒸馏水搅拌煮沸,选用④、⑥和⑦ | |
| C. | 过滤得到的滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的I-,选用③、⑧和⑩ |
9.下列有关化学用语正确的是( )
| A. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | (CH3)2C=CHCH2CH3分子中的六个碳原子中至少有五个在同一个平面上 | |
| D. | 苯分子的比例模型: |
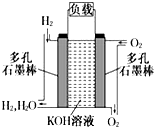 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: