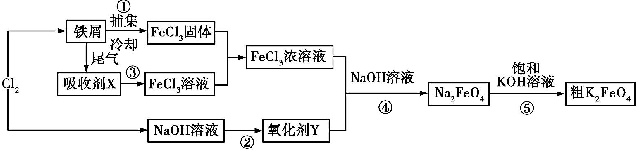
题目内容
7.工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下: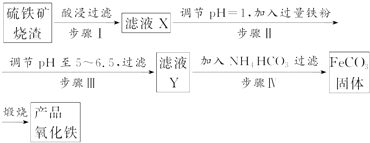
试回答下列问题:
(1)滤液X中含有的金属阳离子是Fe2+、Fe3+(填离子符号).
(2)步骤Ⅲ中可选用B调节溶液的pH(填选项字母).
A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是取试液少许于试管中,先加KSCN溶液,不变色,再加氯水,溶液变红,说明含Fe2+.
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是防止NH4HCO3分解,减少Fe2+的水解.
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
分析 硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)加入硫酸后生成硫酸亚铁、硫酸铁,过滤后得到的滤渣为二氧化硅,滤液中加入过量铁粉,生成硫酸亚铁溶液,调节pH后加入碳酸氢铵溶液,可生成碳酸亚铁固体,经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成氧化铁.
(1)硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等,依据酸浸后铁的氧化物和酸反应溶解,二氧化硅不与酸反应分析判断;
(2)依据步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液PH至5-6.5,试剂不能氧化亚铁离子,不能是碱性强的溶液;
(3)检验铁离子可以使用硫氰化钾溶液,亚铁离子,无法使用硫氰化钾溶液检验,检验亚铁离子,可用氧化剂氧化在进行检验;
(4)温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,原子守恒配平写出.
解答 解:(1)硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等,酸浸后铁的氧化物和酸反应溶解,二氧化硅不与酸反应,氧化铁溶解后生成铁离子,氧化亚铁溶解后生成亚铁离子,
故答案为:Fe2+、Fe3+;
(2)由步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液pH至5-6.5,试剂不能氧化亚铁离子,强碱性溶液会沉淀亚铁离子,
A.稀硝酸具有氢氧化性能氧化亚铁离子,故A不符合;
B.氨水是弱碱,可以调节溶液PH,故B符合;
C.氢氧化钠溶液 是强碱溶液,加入会沉淀亚铁离子,故C不符合;
D.高锰酸钾溶液具有氢氧化性,能氧化亚铁离子,故D不符合;
故答案为:B;
(3)三价铁离子与硫氰根离子发生络合反应生成血红色硫氰合铁络合物,检验铁离子可以使用硫氰化钾溶液,亚铁离子,无法使用硫氰化钾溶液检验,检验亚铁离子,取试液少许于试管中,先加KSCN溶液,不变色,再滴加氯水后,氯气和亚铁离子反应生成铁离子:2Fe2++Cl2=2Fe3++2Cl-,铁离子和硫氰根离子络合Fe3++3SCN-?Fe(SCN)3,呈血红色,说明含Fe2+,
故答案为:取试液少许于试管中,先加KSCN溶液,不变色,再加氯水,溶液变红,说明含Fe2+;
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解,
故答案为:防止NH4HCO3分解,减少Fe2+的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,由原子守恒配平后反应的化学方程式为4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
点评 本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握实验的流程和制备原理,题目难度中等.

(1)写出该反应的平衡常数表达式$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$,KA等于KB(选填“大于”、“小于”或“等于”).
(2)欲增大该反应K值,可以采取的措施为B
A 升高温度 B 降低温度 C 增大N2、H2的浓度 D 使用高效的催化剂
(3)分析以下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]
| 容器A | 容器B | |
| M(平) | 16.7 | |
| 平衡时N2的转化率 | 20% |
(4)常温下将氨气溶于水配成0.1mol/L的氨水100mL,此时溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,则溶液中NH3•H2O的电离程度用电离度表示为1%,水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$增大(填“增大、不变、减小或不确定”)
(5)已知三种酸的电离平衡常数如下表,浓度均为0.1mol/L的NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值分别为a、b、c、d,则a、b、c、d按从大到小的顺序排列为b>a>c>d,写出向NaCN溶液中通入少量CO2气体的离子方程式为CN-+CO2+H2O=HCN+HCO3-.
| 化学式 | 电离常数(298K) |
| 氢氰酸 | K=4.5×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
| A. | 2O3(g)=3O2(g)△H<0 | B. | 2CO(g)=2C(s)+O2(g)△H>0 | ||
| C. | N2(g)+3H2(g)=2NH3(g)△H<0 | D. | CaCO3(s)=CaO(s)+CO2(g)△H>0 |
| A. | HCO${\;}_{3}^{-}$═CO${\;}_{3}^{2-}$+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | H3PO4?3H++PO${\;}_{4}^{3-}$ | D. | NH3•H2O?NH${\;}_{4}^{+}$+OH- |
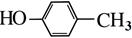 ;
;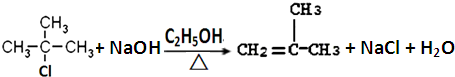 ;
;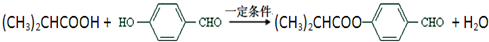 ;
;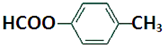 .
.