题目内容
12.某反应过程能量变化如图所示,下列说法正确的是( )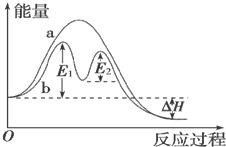
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为放热反应,热效应等于△H | |
| C. | 改变催化剂,不能改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
分析 A、催化剂能降低反应的活化能;
B、反应物能量高于生成物,据此判断反应的吸放热,根据热效应的判断来回答;
C、不同的催化剂对反应的催化效果不同;
D、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能.
解答 解:A、b中使用了催化剂,故A错误;
B、反应物能量高于生成物,反应为放热反应,△H=生成物能量-反应物能量,热效应等于△H,故B正确;
C、不同的催化剂,反应的活化能不同,改变催化剂,能改变该反应的活化能,故C错误;
D、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故D错误.
故选B.
点评 本题通过图象考查了学生对反应的活化能的理解以及催化剂能够降低反应的活化能的相关知识,难度中等.

练习册系列答案
相关题目
2.在某温度下,工业合成氨反应N2+3H2 $?_{催化剂}^{高温、高压}$2NH3(正反应放热),把氮气和氢气以1:1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器的容积固定),在保持相同温度的条件下,A、B两个容器的合成氨反应先后达到平衡状态.请回答:
(1)写出该反应的平衡常数表达式$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$,KA等于KB(选填“大于”、“小于”或“等于”).
(2)欲增大该反应K值,可以采取的措施为B
A 升高温度 B 降低温度 C 增大N2、H2的浓度 D 使用高效的催化剂
(3)分析以下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]
达平衡时,容器A中N2的转化率为10%,容器B中M(平)为18.75,容器A(选填“A”或“B”)体积更大.
(4)常温下将氨气溶于水配成0.1mol/L的氨水100mL,此时溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,则溶液中NH3•H2O的电离程度用电离度表示为1%,水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$增大(填“增大、不变、减小或不确定”)
(5)已知三种酸的电离平衡常数如下表,浓度均为0.1mol/L的NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值分别为a、b、c、d,则a、b、c、d按从大到小的顺序排列为b>a>c>d,写出向NaCN溶液中通入少量CO2气体的离子方程式为CN-+CO2+H2O=HCN+HCO3-.
(1)写出该反应的平衡常数表达式$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$,KA等于KB(选填“大于”、“小于”或“等于”).
(2)欲增大该反应K值,可以采取的措施为B
A 升高温度 B 降低温度 C 增大N2、H2的浓度 D 使用高效的催化剂
(3)分析以下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]
| 容器A | 容器B | |
| M(平) | 16.7 | |
| 平衡时N2的转化率 | 20% |
(4)常温下将氨气溶于水配成0.1mol/L的氨水100mL,此时溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,则溶液中NH3•H2O的电离程度用电离度表示为1%,水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$增大(填“增大、不变、减小或不确定”)
(5)已知三种酸的电离平衡常数如下表,浓度均为0.1mol/L的NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值分别为a、b、c、d,则a、b、c、d按从大到小的顺序排列为b>a>c>d,写出向NaCN溶液中通入少量CO2气体的离子方程式为CN-+CO2+H2O=HCN+HCO3-.
| 化学式 | 电离常数(298K) |
| 氢氰酸 | K=4.5×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
7.下列说法正确的是( )
| A. | 氧化还原反应的特征是电子的转移 | |
| B. | 物质中某元素失去电子,则此物质是还原剂 | |
| C. | 有单质参与的反应一定是氧化还原反应 | |
| D. | 同种元素的价态越高,其氧化性一定越强 |
17.下列各式中,属于正确的电离方程式的是( )
| A. | HCO${\;}_{3}^{-}$═CO${\;}_{3}^{2-}$+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | H3PO4?3H++PO${\;}_{4}^{3-}$ | D. | NH3•H2O?NH${\;}_{4}^{+}$+OH- |
4.一定量的乙醇在氧气不足的情况下燃烧得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为( )
| A. | 1.4 g | B. | 2.2 g | C. | 4.4 g | D. | 在2.2~4.4 g之间 |
2.根据实验室测定硫酸铜晶体结晶水含量的实验,填写下列空白.
(1)实验除了需要电子天平、研钵、药匙、酒精灯、干燥器、玻璃棒、坩埚、三脚架外,还需要的仪器是泥三角、坩埚钳
(2)某学生实验后得到以下数据:
请写出结晶水x=4.97.(保留2位小数)
实验误差=-0.6%.(保留2位小数)
提示:实验误差=(实验值-理论值)/理论值)×100%
从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥
B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失.
(1)实验除了需要电子天平、研钵、药匙、酒精灯、干燥器、玻璃棒、坩埚、三脚架外,还需要的仪器是泥三角、坩埚钳
(2)某学生实验后得到以下数据:
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.002g |
实验误差=-0.6%.(保留2位小数)
提示:实验误差=(实验值-理论值)/理论值)×100%
从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥
B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失.