题目内容
1.氢化钠(NaH)是一种白色晶体,NaH与水反应放出H2,下列叙述正确的是( )| A. | NaH在水中显酸性 | B. | NaH中氢离子电子层排布与氦相同 | ||
| C. | NaH中氢离子半径比锂离子半径小 | D. | NaH中氢离子被还原为H2 |
分析 A.NaH与水反应放出H2,发生反应:NaH+H2O=NaOH+H2↑;
B.NaH中氢离子与Ne原子核外电子数均为2;
C.电子层结构相同,核电荷数越大离子半径越小;
D.NaH中氢离子为-1价,被氧化为H2.
解答 解:A.NaH与水反应放出H2,发生反应:NaH+H2O=NaOH+H2↑,在水中显碱性,故A错误;
B.NaH中氢离子与Ne原子核外电子数均为2,二者核外电子排布相同,故B正确;
C.NaH中氢离子与锂离子电子层结构相同,核电荷数越大离子半径越小,故NaH中氢离子半径比锂离子半径大,故C错误;
D.NaH中氢离子为-1价,被氧化为H2,水中氢元素比还原为氢气,故D错误,
故选B.
点评 本题考查原子结构与性质,难度不大,注意根据氧化还原反应角度理解NaH与水的反应.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
11.下列说法正确的是( )
| A. | 科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用SMT技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 | |
| B. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 | |
| C. | 今年,来自德国、加拿大和我国复旦、清华大学的研究人员通过紧密合作,成功制备出了含+9铱元素的离子(IrOn+).在这种离子中,n=8 | |
| D. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
12.与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH3CHO→C2H5OH | B. | C2H5OH→CH2=CH2 | ||
| C. | 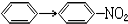 | D. | CH3COOH→CH3COOC2H5 |
9.下列反应中属于消去反应的是( )
| A. | 溴乙烷与NaOH醇溶液共热 | B. | 甲苯与浓硫酸和浓硝酸的反应 | ||
| C. | 溴乙烷与NaOH水溶液共热 | D. | 甲烷与氯气在光照的条件下反应 |
6.若只改变下列中的一个条件,能使N2(g)+3H2(g)?2NH3(g)△H<0平衡向逆反应方向移动的是( )
| A. | 升高温度 | B. | 增大压强 | C. | 增大NH3的浓度 | D. | 使用催化剂 |
13.下列化学用语对应正确的是( )
| A. | Cl-离子的结构示意图: | B. | 白磷分子的比例模型: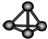 | ||
| C. | H2O2的结构式:H-O-O-H | D. | CCl4的电子式: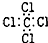 |
10.对于常温下0.1mol•L-1氨水和0.1mol•L-1醋酸,下列说法正确的是( )
| A. | 0.1mol•L-1醋酸,溶液的pH=1 | |
| B. | 0.1mol•L-1醋酸加水稀释,溶液中离子浓度都减小 | |
| C. | 0.1mol•L-1氨水溶液中:c(OH-)=c(NH${\;}_{4}^{+}$) | |
| D. | 0.1mol•L-1氨水与0.1mol•L-1 HCl溶液等体积混合所得溶液中:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) |
18.下列微粒的个数比不是1:1的是( )
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 | ||
| C. | Na2O2固体中阴、阳离子 | D. | ${\;}_{1}^{2}$H原子中的质子和中子 |