题目内容
16.5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,求甲的分子式是?分析 根据甲蒸气对氢气的相对密度计算甲的相对分子质量,根据n=$\frac{m}{M}$计算甲的物质的量,再根据C、H原子守恒计算甲分子中C、H原子数目,根据相对分子质量计算分子中O原子数目,进而确定甲的分子式.
解答 解:甲蒸气对氢气的相对密度是29,则Mr(甲)=29×2=58,
5.8g甲的物质的量为$\frac{5.8g}{58g/mol}$=0.1mol,
则甲分子中N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.3mol×2}{0.1mol}$=6,故分子中N(O)=$\frac{58-12×3-6}{16}$=1,
故甲的分子式为:C3H6O,
答:甲的分子式为C3H6O.
点评 本题考查有机物分子式确定的计算,比较基础,注意理解掌握燃烧法利用原子守恒确定有机物分子式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.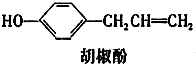 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( )
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( )
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④该化合物与溴水反应,1mol最多可与2mol Br2发生反应.
 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( )
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( )①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④该化合物与溴水反应,1mol最多可与2mol Br2发生反应.
| A. | ①③ | B. | ①②④ | C. | ②③ | D. | ②③④ |
7.下列说法全部正确的一组是( )
①石油、煤、天然气、可燃冰、油脂都属于化石燃料
②石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
③淀粉、纤维素、蛋白质、蔗糖都是高分子化合物
④只用一种试剂可以实现乙醇、甲苯、溴苯三种试剂的鉴别
⑤甲烷、乙烯和苯在工业上都可通过石油的分馏得到
⑥人类借助扫描隧道显微镜,应用STM技术实现对原子或分子的操纵
⑦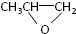 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物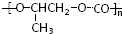 ,该反应符合绿化学的原则.
,该反应符合绿化学的原则.
①石油、煤、天然气、可燃冰、油脂都属于化石燃料
②石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
③淀粉、纤维素、蛋白质、蔗糖都是高分子化合物
④只用一种试剂可以实现乙醇、甲苯、溴苯三种试剂的鉴别
⑤甲烷、乙烯和苯在工业上都可通过石油的分馏得到
⑥人类借助扫描隧道显微镜,应用STM技术实现对原子或分子的操纵
⑦
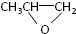 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物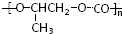 ,该反应符合绿化学的原则.
,该反应符合绿化学的原则.| A. | ①②③⑤ | B. | ①③④ | C. | ②④⑥⑦ | D. | ⑤⑥⑦ |
11.由2-氯丙烷制得少量的CH2OHCHOHCH3 需要经过下列几步反应( )
| A. | 加成→消去→取代 | B. | 消去→加成→水解 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
1.氢化钠(NaH)是一种白色晶体,NaH与水反应放出H2,下列叙述正确的是( )
| A. | NaH在水中显酸性 | B. | NaH中氢离子电子层排布与氦相同 | ||
| C. | NaH中氢离子半径比锂离子半径小 | D. | NaH中氢离子被还原为H2 |
5.炼铁高炉中冶炼铁的反应为:Fe2O3(s)+3CO(g)$\frac{\underline{\;高温\;}}{\;}$2Fe(s)+3CO2(g),下列说法正确的是( )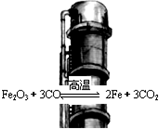

| A. | 升高温度,反应速率减慢 | |
| B. | 当反应达到化学平衡时,υ(正)=υ(逆)=0 | |
| C. | 提高炼铁高炉的高度可减少尾气中CO的浓度 | |
| D. | 某温度下达到平衡时,CO的体积分数基本不变 |
13.下列叙述正确的是( )
| A. | 非金属元素的原子最外层电子数都大于或等于4 | |
| B. | 只有非金属能形成含氧酸或含氧酸盐 | |
| C. | Na2O2中阴阳离子的个数比为1:1 | |
| D. | 非金属元素组成的化合物不一定是共价化合物 |
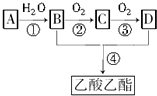 已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;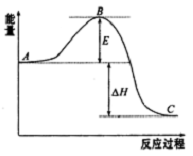 2SO2(g)+O2 (g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2 (g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1