题目内容
13.下列化学用语对应正确的是( )| A. | Cl-离子的结构示意图: | B. | 白磷分子的比例模型: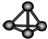 | ||
| C. | H2O2的结构式:H-O-O-H | D. | CCl4的电子式: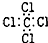 |
分析 A.氯离子核电荷数为17,核外电子数为18;
B.比例模型反应分子的相对大小;
C.双氧水分子中存在两个碳氢键和1个氧氧单键;
D.四氯化碳分子中,漏掉了氯原子的3对孤对电子.
解答 解:A.氯离子的核电荷数为17,核外电子数为18,其正确的离子结构示意图为: ,故A正确;
,故A正确;
B.比例模型反应分子的相对大小, 为球棍模型,故B错误;
为球棍模型,故B错误;
C.双氧水为共价化合物,其分子中存在两个氧氢键和1个氧氧单键,双氧水的结构式为:H-O-O-H,故C错误;
D.四氯化碳中碳原子和氯原子均满足8电子稳定结构,其正确的电子式为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了电子式、比例模型、离子结构示意图、结构式的判断,题目难度中等,注意掌握常见的化学用语的概念及正确表示方法,试题培养了学生规范答题的能力.

练习册系列答案
相关题目
3.某气体中可能含NH3.HI.Cl2.CO2中一种或几种.将该气体通入硝酸银溶液产生黄色沉淀;将该气体通入澄清石灰水未观察到白色沉淀,则该气体( )
①一定含有HI ②一定不含CO2 ③可能含有CO2④一定不含NH3 ⑤一定不含Cl2.
①一定含有HI ②一定不含CO2 ③可能含有CO2④一定不含NH3 ⑤一定不含Cl2.
| A. | ①②④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②⑤ |
1.氢化钠(NaH)是一种白色晶体,NaH与水反应放出H2,下列叙述正确的是( )
| A. | NaH在水中显酸性 | B. | NaH中氢离子电子层排布与氦相同 | ||
| C. | NaH中氢离子半径比锂离子半径小 | D. | NaH中氢离子被还原为H2 |
18.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是( )


| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
5.炼铁高炉中冶炼铁的反应为:Fe2O3(s)+3CO(g)$\frac{\underline{\;高温\;}}{\;}$2Fe(s)+3CO2(g),下列说法正确的是( )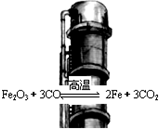

| A. | 升高温度,反应速率减慢 | |
| B. | 当反应达到化学平衡时,υ(正)=υ(逆)=0 | |
| C. | 提高炼铁高炉的高度可减少尾气中CO的浓度 | |
| D. | 某温度下达到平衡时,CO的体积分数基本不变 |
10.对于反应:A+B?C,下列条件的改变一定能使化学反应速率加快的是( )
| A. | 增加体系的压强 | B. | 减少C的物质的量浓度 | ||
| C. | 增加A的物质的量 | D. | 升高体系的温度 |
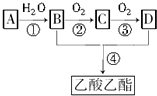 已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;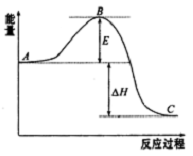 2SO2(g)+O2 (g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2 (g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1 .
.