题目内容
10.对于常温下0.1mol•L-1氨水和0.1mol•L-1醋酸,下列说法正确的是( )| A. | 0.1mol•L-1醋酸,溶液的pH=1 | |
| B. | 0.1mol•L-1醋酸加水稀释,溶液中离子浓度都减小 | |
| C. | 0.1mol•L-1氨水溶液中:c(OH-)=c(NH${\;}_{4}^{+}$) | |
| D. | 0.1mol•L-1氨水与0.1mol•L-1 HCl溶液等体积混合所得溶液中:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) |
分析 A.醋酸是弱电解质,在水溶液里部分电离;
B.加水稀释促进醋酸电离,但溶液中氢离子浓度减小,温度不变,水的离子积常数不变,据此判断氢氧根离子浓度;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.等物质的量的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,再结合电荷守恒判断.
解答 解:A.醋酸氨是弱电解质,在水溶液里部分电离,所以醋酸溶液中存在电离平衡,则0.1mol•L-1醋酸,溶液的pH>1,故A错误;
B.加水稀释促进醋酸电离,氢离子增多个数小于溶液体积增大倍数,所以溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(OH-)=c(NH4+)+c(H+),故C错误;
D.等物质的量的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),盐类水解较微弱,所以c(NH4+)>c(H+),该溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查了弱电解质的电离及盐类水解,常常与离子浓度大小比较联系考查,根据弱电解质电离特点及电荷守恒解答,易错选项是B,注意稀释醋酸时,醋酸溶液中只有氢氧根离子浓度增大,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列物质中硫元素只显示氧化性的是( )
| A. | HgS | B. | SO2 | C. | S | D. | H2SO4 |
1.氢化钠(NaH)是一种白色晶体,NaH与水反应放出H2,下列叙述正确的是( )
| A. | NaH在水中显酸性 | B. | NaH中氢离子电子层排布与氦相同 | ||
| C. | NaH中氢离子半径比锂离子半径小 | D. | NaH中氢离子被还原为H2 |
18.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是( )


| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
5.炼铁高炉中冶炼铁的反应为:Fe2O3(s)+3CO(g)$\frac{\underline{\;高温\;}}{\;}$2Fe(s)+3CO2(g),下列说法正确的是( )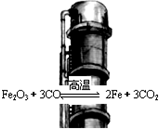

| A. | 升高温度,反应速率减慢 | |
| B. | 当反应达到化学平衡时,υ(正)=υ(逆)=0 | |
| C. | 提高炼铁高炉的高度可减少尾气中CO的浓度 | |
| D. | 某温度下达到平衡时,CO的体积分数基本不变 |
6.某无色溶液,只可能含有下表中的几种离子.
进行如下实验分析其组成:
①取10mL该溶液试管中,滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色产生乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,气体丙逸出,将收集的气体丙的体积换算成标准状况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
①取10mL该溶液试管中,滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色产生乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,气体丙逸出,将收集的气体丙的体积换算成标准状况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
 .
.