题目内容
13.下列离子方程式书写正确的是( )| A. | Na放入水中:Na+2H2O=Na++OH-+2H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
分析 A、选项中原子不守恒;
B、醋酸是弱酸不能拆成离子;
C、铜活泼性大于银,可以从银盐溶液中置换出银;
D、离子方程式中氢氧化钡和硫酸1:1反应,离子组成必须符合化学式组成比;
解答 解:A、选项中原子不守恒,Na放入水中反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B、醋酸是弱酸不能拆成离子,碳酸钙溶于醋酸中反应的离子方程式:CaCO3+2CH3COOH═Ca2++2H2O+2CH3COO-+CO2↑,故B错误;
C、铜活泼性大于银,可以从银盐溶液中置换出银,硝酸银溶液中加入铜粉反应的离子方程式:2Ag++Cu═Cu2++2Ag,故C正确;
D、离子方程式中氢氧化钡和硫酸1:1反应,离子组成必须符合化学式组成比,Ba(OH)2与稀H2SO4反应的离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式书写原则和正误判断,注意弱电解质、离子反应的组成比、电荷守恒和原子守恒分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
1.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO和KClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 参加反应的氯气的物质的量等于0.5a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{a}{6}$mol |
5.在恒温恒容的密闭容器中,反应A(g)+B(s)?2C(g)达到化学平衡状态的是( )
| A. | 消耗1molA的同时消耗1mol B | B. | 消耗n molA,同时生成2nmolC | ||
| C. | 气体的总体积不变 | D. | 容器内气体密度不变 |
2.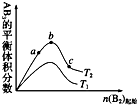 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )| A. | T1<T2,平衡常数 K1<K2 | |
| B. | 达到平衡时 A2 的转化率大小为 b>a>c | |
| C. | a、b、c 三点的平衡常数 Kb>Ka>Kc | |
| D. | 达到平衡时,AB3 的物质的量大小为 c>b>a |
3.下列各冶炼方法中,不能制得相应金属的是( )
| A. | 加热氧化铝 | B. | 电解熔融氯化钠 | ||
| C. | 把铁放入硫酸铜溶液中 | D. | 铝粉与氧化铁高温共热 |
 .
.