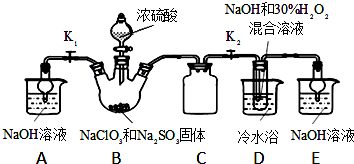
题目内容
3.焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶.其性质活泼,具有强还原性,在食品加工中作防腐剂、漂白剂、疏松剂.某实验小组拟采用如图1装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.如果想控制反应速度,如图2中可选用的发生装置是ac(填写字母).
(2)装置Ⅱ中发生反应的化学方程式为:2NaHSO3=Na2S2O5+H2O
当有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是过滤;某同学需要420mL0.1mol/L焦亚硫酸钠溶液来研究其性质,配制时需称量焦亚硫酸钠的质量为9.5g;配制时除用到托盘天平、药匙、烧杯、玻璃棒等仪器外,还必须用到的玻璃仪器是500mL的容量瓶、胶头滴管.
(3)装置Ⅲ用于处理尾气,可选用如图3的最合理装置(夹持仪器已略去)为d(填序号).
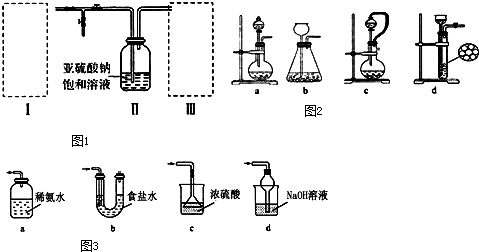
分析 (1)装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;根据分液漏斗和长颈漏斗的特点结合气压原理来回答;
(2)固体和液体的分离采用过滤法;根据m=nM=cVM来计算质量;配制一定物质的量浓度的溶液使用的仪器:天平、药匙、烧杯、玻璃棒、500mL的容量瓶、胶头滴管;
(3)二氧化硫属于酸性氧化物,有毒,要处理尾气,容易和氢氧化钠反应,但是要防止倒吸.
解答 解:(1)装置Ⅰ中亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,如果想控制反应速度,用分液漏斗比长颈漏斗好得多,a装置可以,保证气压畅通,液体顺利留下,如图2中还可选用的发生装置是c,橡皮管能使分液漏斗与圆底烧瓶内气压相等,便于液体流下;
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;ac;
(2)装置Ⅱ中有Na2S2O5晶体析出,固体和液体的分离采用过滤法,要获得已析出的晶体可采取的分离方法是过滤;配制时应该用5molmL的容量瓶,没有480mL的,即需称量焦亚硫酸钠的质量m=nM=cVM=0.5L×0.1mol/L×190g/mol=9.5g;配制一定物质的量浓度的溶液使用的仪器:天平、药匙、烧杯、玻璃棒、500mL的容量瓶、胶头滴管,
故答案为:过滤;9.5g;500mL的容量瓶、胶头滴管;
(3)二氧化硫有毒,要处理尾气,属于酸性氧化物,更容易和强碱氢氧化钠反应,但是要防止倒吸,最合理装置应该选择d,
故答案为:d.
点评 本题考查物质的制备实验、实验方案设计,为高频考点,侧重于学生的分析能力、实验能力的考查,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案| A. | CO2 | B. | CaO | C. | H2O | D. | Na2O |
| A. | Na放入水中:Na+2H2O=Na++OH-+2H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
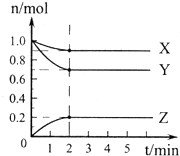 (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y 2Z.
2Z. 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化: