题目内容
1.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO和KClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 参加反应的氯气的物质的量等于0.5a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{a}{6}$mol |
分析 A.令n(ClO-)=1mol,则n(Cl-)=2mol,根据电子转移守恒计算n(ClO3-);
B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),联立计算参加反应氯气的物质的量;
C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),进而计算转移电子物质的量范围;
D.氧化产物只有KClO3时,其物质的量最大,由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),结合电子转移守恒计算.
解答 解:A.令n(ClO-)=1mol,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则n(Cl-)=2mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×2mol,解得n(ClO3-)=0.2mol,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=5,故A错误;
B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量=$\frac{1}{2}$n(KOH)=0.5amol,故B正确;
C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=$\frac{1}{6}$n(KOH)=$\frac{1}{6}$a mol,转移电子最大物质的量为:$\frac{1}{6}$a mol×5=$\frac{5}{6}$a mol,
氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)=$\frac{1}{2}$n(KOH)=$\frac{1}{2}$a mol,转移电子最小物质的量=$\frac{1}{2}$a mol×1=$\frac{1}{2}$a mol,则反应中转移电子的物质的量ne的范围为:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol,故C正确;
D.氧化产物只有KClO3时,其物质的量最大,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n最大(KClO3)=$\frac{1}{6}$n(KOH)=$\frac{1}{6}$a mol,故D正确,
故选:A.
点评 本题考查氧化还原反应计算,难度中等,注意电子转移守恒及极限法的应用,侧重考查学生分析计算能力.

 天天练口算系列答案
天天练口算系列答案| A. | CO2 | B. | CaO | C. | H2O | D. | Na2O |
| A. | Na放入水中:Na+2H2O=Na++OH-+2H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | 25℃,将pH=4的盐酸和醋酸分别加水稀释成pH=5,所加水的量 | |
| B. | 25℃,pH=10的NaOH溶液和Na2CO3溶液中,由水电离出的c(OH-) | |
| C. | 25℃,物质的量浓度相等的 (NH4)2SO4和 (NH4)2CO3溶液中的c(NH4+) | |
| D. | 25℃,Na2CO3溶液中HCO3-和OH-的数目 |
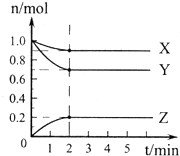 (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y 2Z.
2Z.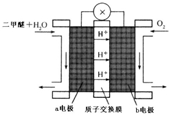 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
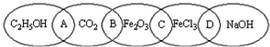 如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题:
如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题: HCO3-+OH-(用离子方程式表示);
HCO3-+OH-(用离子方程式表示);