题目内容
18.现有某气体,它由双原子分子构成,其摩尔质量为M g•mol-1,则ag该气体在标准状况下的体积约为$\frac{22.4a}{M}$L.分析 根据n=$\frac{m}{M}$计算气体物质的量,再根据V=nVm计算气体体积.
解答 解:ag 气体的物质的量为$\frac{ag}{Mg/mol}$=$\frac{a}{M}$mol,标况下气体的体积为:$\frac{a}{M}$mol×22.4L/mol=$\frac{22.4a}{M}$L,
故答案为:$\frac{22.4a}{M}$.
点评 本题考查物质的量计算,比较基础,注意掌握以物质的量为中心的计算.

练习册系列答案
相关题目
13.下列离子方程式书写正确的是( )
| A. | Na放入水中:Na+2H2O=Na++OH-+2H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
3.下列说法正确的是( )
| A. | 焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 | |
| B. | 熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | △G<0的反应是自发的,因此在任何条件均可发生 |
8.在一定条件下,反应N2+3H2?2NH3 在2L密闭容器中进行,10min时NH3的质量增加了3.4g,则反应速率为( )
| A. | υ(H2)=0.02 mol/(L•min) | B. | υ(N2)=0.02 mol/(L•min) | ||
| C. | υ(NH3)=0.01 mol/(L•min) | D. | υ(N2)=0.01 mol/(L•min) |
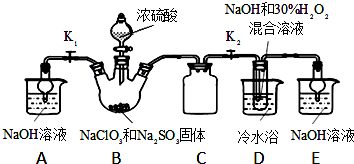
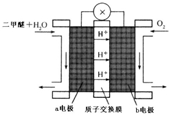 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: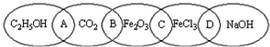 如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题:
如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题: HCO3-+OH-(用离子方程式表示);
HCO3-+OH-(用离子方程式表示);