题目内容
8.在反应Cu+4HN03(浓)═Cu(NO3)2+2NO2↑+2H2O中:(1)该反应被氧化的元素Cu,被还原的元素N.(填元素符号)
(2)该反应中氧化剂为HN03,还原剂为Cu; 氧化产物为Cu(NO3)2,还原产物为NO2.
(3)用双线桥法,只标出该反应的电子得失方向和数目:
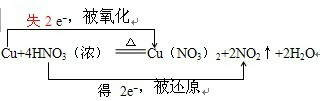 .
.
分析 Cu+4HN03(浓)═Cu(NO3)2+2NO2↑+2H2O反应中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+4价,以此来解答.
解答 解:(1)8HNO3+3Cu═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价升高,该元素的原子失电子,被氧化;N元素的化合价降低,得电子,被还原;
故答案为:Cu;N;
(2)反应中,Cu元素的化合价升高,被氧化,则Cu为还原剂,对应的Cu(NO3)2为氧化产物;N元素的化合价降低,被还原,则HNO3为氧化剂,NO2为还原产物,
故答案为:HNO3;Cu;Cu(NO3)2;NO2;
(3)反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,HNO3→NO2,N元素由+5价→+4价,其得失电子数为2,所以其转移电子数为2,则 ,
,
故答案为: .
.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
13.下列离子方程式书写正确的是( )
| A. | Na放入水中:Na+2H2O=Na++OH-+2H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
17.“高分八号”高分辨率对地观测系统光学遥感卫星在我国太原成功发射,如图示为某卫星的能量转 化示意图,其中燃料电池以 KOH 溶液为电解液,下列说法不正确的是( )
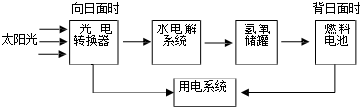

| A. | 整个系统实现了物质零排放及能量间的完全转化 | |
| B. | 燃料电池的负极反应式为 H2+2OH--2e-═2H2O | |
| C. | 水电解系统中加入 Na2SO4 可增加溶液导电性 | |
| D. | 该系统的总反应式为 2H2+O2$?_{充电}^{放电}$2H2O |
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化: Ⅰ时,反应物A的转化率a(A)=60%.x:y=1:2.
Ⅰ时,反应物A的转化率a(A)=60%.x:y=1:2.
 .
.