题目内容
2.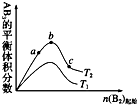 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )| A. | T1<T2,平衡常数 K1<K2 | |
| B. | 达到平衡时 A2 的转化率大小为 b>a>c | |
| C. | a、b、c 三点的平衡常数 Kb>Ka>Kc | |
| D. | 达到平衡时,AB3 的物质的量大小为 c>b>a |
分析 A、由图可知,B2起始相同时,T2对应的AB3的含量大,则若该正反应为吸热反应,则T2>T1,若该正反应为放热反应,则T2<T1;
B、由图可知B2越大,达到平衡时A2的转化率越大;
C、平衡常数随温度变化,abc点是铜温度下的平衡移动,平衡常数不变;
D、对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,生成物的物质的量增多;且b点AB3的体积分数最大,则反应物的物质的量之比接近等于化学计量数之比,以此来解答.
解答 解:A、若T2>T1,由图象可知温度升高生成物的物质的量增大,说明升高温度平衡向正反应分析移动,则正反应为吸热反应,升温平衡正向进行,平衡常数增大,所以K1<K2,故A正确;
B、根据图象可知,a、b、c各点中B的起始物质的量依次增大,对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,则另一种反应物的转化率增大,则达到平衡时A2的转化率大小为:a<b<c,故B错误;
C、根据图象可知,a、b、c各点中B的起始物质的量依次增大,则反应物的浓度依次增大,反应速率依次增大,但温度不变,平衡常数不变,故C错误;
D、对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,生成物的物质的量增多,所以达到平衡时,AB3的物质的量大小为c>b>a,故D正确;
故选:AD.
点评 本题考查化学反应速率及化学平衡图象,明确横坐标为反应物B2的物质的量及该反应可能为吸热反应,也可能为放热反应是解答本题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列物属于酸性氧化物的是( )
| A. | CO2 | B. | CaO | C. | H2O | D. | Na2O |
13.下列离子方程式书写正确的是( )
| A. | Na放入水中:Na+2H2O=Na++OH-+2H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
17.“高分八号”高分辨率对地观测系统光学遥感卫星在我国太原成功发射,如图示为某卫星的能量转 化示意图,其中燃料电池以 KOH 溶液为电解液,下列说法不正确的是( )
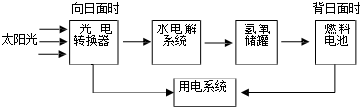

| A. | 整个系统实现了物质零排放及能量间的完全转化 | |
| B. | 燃料电池的负极反应式为 H2+2OH--2e-═2H2O | |
| C. | 水电解系统中加入 Na2SO4 可增加溶液导电性 | |
| D. | 该系统的总反应式为 2H2+O2$?_{充电}^{放电}$2H2O |
14.下列离子在溶液中可以大量共存的一组是( )
| A. | Mg2+、Na+、Cl-、OH- | B. | Na+、Ca2+、NO3-、CO32- | ||
| C. | K+、H+、Na+、HCO3- | D. | Na+、K+、NO3-、Cl- |
11.下列各项中所述的两个量,前者一定大于后者的是( )
| A. | 25℃,将pH=4的盐酸和醋酸分别加水稀释成pH=5,所加水的量 | |
| B. | 25℃,pH=10的NaOH溶液和Na2CO3溶液中,由水电离出的c(OH-) | |
| C. | 25℃,物质的量浓度相等的 (NH4)2SO4和 (NH4)2CO3溶液中的c(NH4+) | |
| D. | 25℃,Na2CO3溶液中HCO3-和OH-的数目 |
 HCO3-+OH-(用离子方程式表示);
HCO3-+OH-(用离子方程式表示);