题目内容
11.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)Z的第一电离能比W的小(填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称CH3CH2OH、CH3COOH等.
(3)W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
分析 短周期元素中,Y是地壳中含量最高的元素,则Y为O元素;X的最高价氧化物对应的水化物化学式为H2XO3,则X的最高化合价为+4,结合原子序数Y>X,可确定X为C元素,Z的基态原子最外层电子排布式为3s23p1,即Z为Al元素;W的一种核素的质量数为28,中子数为14,可确定W的质子数为28-14=14,即W为Si,据此解答.
解答 解:短周期元素中,Y是地壳中含量最高的元素,则Y为O元素;X的最高价氧化物对应的水化物化学式为H2XO3,则X的最高化合价为+4,结合原子序数Y>X,可确定X为C元素,Z的基态原子最外层电子排布式为3s23p1,即Z为Al元素;W的一种核素的质量数为28,中子数为14,可确定W的质子数为28-14=14,即W为Si.
(1)Si位于元素周期表第三周期第ⅣA族,同主族元素原子半径从上到下依次增大,则W(Si)的原子半径比X(C)的要大,
故答案为:三;ⅣA;大;
(2)因周期元素从左到右,元素的第一电离能呈增大趋势,故Z(Al) 的第一电离能比W(Si)的要小.XY2(CO2)为分子晶体,由固态变为气态,克服的是分子间作用力.由C、H、O组成的分子中,存在分子间氢键的物质很多,如:CH3CH2OH、CH3COOH等,
故答案为:小;分子间作用力;CH3CH2OH、CH3COOH等;
(3)W单质为硅,硅和氢氟酸反应生成SiF4和H2两种气体,反应方程式为:Si+4HF=SiF4↑+2H2↑,故答案为:Si+4HF=SiF4↑+2H2↑.
点评 本题考查位置结构性质关系应用,明确元素种类是解题关键,注意掌握同周期元素第一电离能异常情况.

练习册系列答案
相关题目
2.根据元素周期表,下列叙述正确的是( )
| A. | 钾与铯同一主族,铯比钾更容易从水中置换出氢 | |
| B. | 溴化钾与碘化钾溶液置于空气中,溴化钾更容易变质 | |
| C. | 卤族元素气态氢化物的水溶液的酸性,从上到下依次减弱 | |
| D. | 卤族元素最高价氧化物对应水化物的酸性从上到下增强 |
19.下列说法正确的是( )
| A. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| B. | 乙烯与溴发生加成反应的产物为溴乙烷 | |
| C. | 1 mol 苯恰好与3 mol氢气完全加成,说明一个苯分子中有三个碳碳双键 | |
| D. | n=7,主链上有5个碳原子烷烃共有五种 |
16.下列说法正确的是( )
| A. | 酸式盐的水溶液一定显碱性 | |
| B. | 只要酸和碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 | |
| C. | 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等 | |
| D. | 碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的2倍 |
20.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
1.酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9~3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占的分数(a)与pH的关系如图所示.下列表述不正确的是( )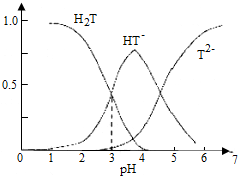

| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |

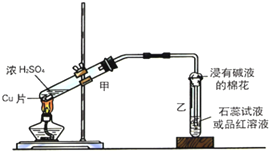 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.