题目内容
19.下列说法正确的是( )| A. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| B. | 乙烯与溴发生加成反应的产物为溴乙烷 | |
| C. | 1 mol 苯恰好与3 mol氢气完全加成,说明一个苯分子中有三个碳碳双键 | |
| D. | n=7,主链上有5个碳原子烷烃共有五种 |
分析 A.烷烃的通式为CnH2n+2,C元素的质量分数为$\frac{12n}{14n+2}$=$\frac{12}{14+\frac{2}{n}}$;
B.乙烯中含碳碳双键,与溴发生加成反应;
C.苯中不含碳碳双键;
D.n=7,主链上有5个碳原子的烷烃,支链为2个甲基或1个乙基,可以看作取代戊烷形成的物质.
解答 解:A.烷烃的通式为CnH2n+2,C元素的质量分数为$\frac{12n}{14n+2}$=$\frac{12}{14+\frac{2}{n}}$,则随n值增大,碳元素的质量百分含量逐渐增大,故A错误;
B.乙烯中含碳碳双键,可与溴水发生加成反应生成1,2-二溴乙烷,故B错误;
C.苯中不含碳碳双键,但1 mol摩尔苯恰好与3摩尔氢气完全加成,故C错误;
D.n=7,主链上有5个碳原子的烷烃,支链为2个甲基或1个乙基,符合的有(CH3)3CCH2CH2CH3、CH3CH2C(CH3)2CH2CH3、CH3CH2CH(CH2CH3)CH2CH3、(CH3)2CHCH2CH(CH3)2、(CH3)2CHCH(CH3)CH2CH3,共5种,故D正确;
故选D.
点评 本题考查有机物的结构与性质,选项D为解答的易错点,注意减链法书写同分异构体,注重基础知识的考查,题目难度不大.

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
9.下列各组离子一定能大量共存的是( )
| A. | 强酸性溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 强碱溶液中:Na+、K+、[Al(OH)4]-、CO32- | |
| C. | 强碱性溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
10.常用的下列量器刻度表示正确的是( )
①量筒的刻度由下向上增大,无零刻度
②在250mL容量瓶上,除刻度线外,还标有250mL和20℃
③滴定管的刻度是由上向下增大,零刻度在上
④温度计的刻度由下向上增大,零刻度偏下
⑤用托盘天平称量样品质量时,指针应在标尺的中央.
①量筒的刻度由下向上增大,无零刻度
②在250mL容量瓶上,除刻度线外,还标有250mL和20℃
③滴定管的刻度是由上向下增大,零刻度在上
④温度计的刻度由下向上增大,零刻度偏下
⑤用托盘天平称量样品质量时,指针应在标尺的中央.
| A. | ②③正确 | B. | ①②⑤正确 | C. | 都正确 | D. | ②③④⑤正确 |
4.Ⅰ.已知25℃时有关弱酸的电离平衡常数:
(1)25℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示:
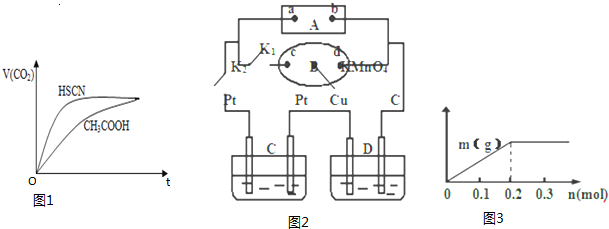
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快
(2)若保温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数
Ⅱ.某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11.在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va:Vb=10:1.
Ⅲ.如图2所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液均见图示.
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为负极,通电开始时,滤纸d端的电极反应式是2H++2e-=H2↑.
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图3所示.则Cu2+、X3+、H+氧化能力由大到小的顺序是Cu2+>H+>X3+;D装置中溶液是H2SO4,则此装置电极C端的实验现象是在C端开始时有无色无味气体产生,一段时间后有红色物质析出.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快
(2)若保温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数
Ⅱ.某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11.在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va:Vb=10:1.
Ⅲ.如图2所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液均见图示.
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为负极,通电开始时,滤纸d端的电极反应式是2H++2e-=H2↑.
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图3所示.则Cu2+、X3+、H+氧化能力由大到小的顺序是Cu2+>H+>X3+;D装置中溶液是H2SO4,则此装置电极C端的实验现象是在C端开始时有无色无味气体产生,一段时间后有红色物质析出.
11.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W位于元素周期表第三周期第ⅣA族;W的原子半径比X的大(填“大”或“小”).
(2)Z的第一电离能比W的小(填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称CH3CH2OH、CH3COOH等.
(3)W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)Z的第一电离能比W的小(填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称CH3CH2OH、CH3COOH等.
(3)W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
8.已知2SO2(g)+O2(g)?2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是( )
| A. | 升高温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2不能完全转化为SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度一定相等 |
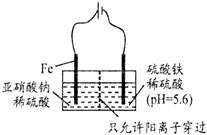 利用15N可以测定亚硝酸盐对地下水质的污染情况.
利用15N可以测定亚硝酸盐对地下水质的污染情况.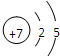 ,15N2的结构式为15N≡15N;
,15N2的结构式为15N≡15N;
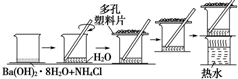 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题: