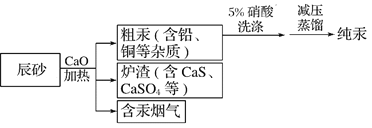
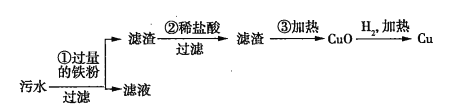
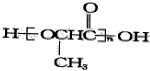
题目内容
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I![]() = H2O + IO
= H2O + IO![]() ;H2O2 + IO
;H2O2 + IO![]() = H2O + O2↑+ I
= H2O + O2↑+ I![]() 。总反应的化学方程式是_______________________________________________。
。总反应的化学方程式是_______________________________________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______(填字母)。
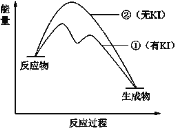
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I![]() = H2O + IO
= H2O + IO![]() 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________。
(4)资料4:I![]() + I
+ I![]()
![]() I
I![]() K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I | I | I |
浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
① a =____________________。
② 该平衡体系中除了含有I![]() 、I
、I![]() 和I
和I![]() 外,一定还含有其他含碘微粒,理由是_____________________。
外,一定还含有其他含碘微粒,理由是_____________________。
【答案】2H2O2 = 2H2O+O2↑ a 下层溶液呈紫红色 在水溶液中I2的浓度降低 B试管中产生气泡速率没有明显减小 2.5×10-3 2c(I2) + c(I -) + 3c(I3-)<0.033 mol·L-1
【解析】
(1)将两个反应叠加;
(2)![]() 起催化剂作用;
起催化剂作用;
(3)①四氯化碳萃取碘;
②气泡明显减少的原因也可能是碘的浓度降低;做对比实验;
(4)①根据平衡常数进行计算;
②根据元素守恒判断。
(1)将两个反应叠加得到:![]() ,
,
故答案为:![]() ;
;
(2)a.![]() 起催化剂作用,加入催化剂改变了反应历程,从而降低活化能,a正确;
起催化剂作用,加入催化剂改变了反应历程,从而降低活化能,a正确;
b.根据盖斯定律,总反应的能量变化不变,b错误;
c.![]() 是前半段反应,根据图像该反应是吸热反应,c错误;
是前半段反应,根据图像该反应是吸热反应,c错误;
答案选a。
(3)①碘易溶于四氯化碳,且四氯化碳密度大于水,与水分层在下层, 碘进入下层的四氯化碳中显紫红色,
故答案为:下层溶液呈紫红色;
②气泡明显减少的原因也可能是碘的浓度降低;做对比实验,ⅰ不是主要原因,则说明不加四氯化碳反应速率变化不大,
故答案为:在水溶液中I2的浓度降低;B试管中产生气泡速率没有明显减小;
(4)①根据平衡常数进行计算,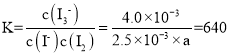 ,解得a= 2.5×10-3,
,解得a= 2.5×10-3,
故答案为:2.5×10-3;
②根据元素守恒判断,![]() 与
与![]() 对比,
对比,
故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是( )
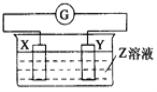
选项 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB. BC. CD. D
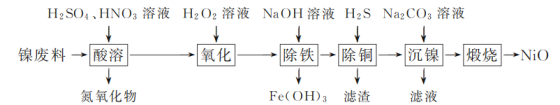
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。