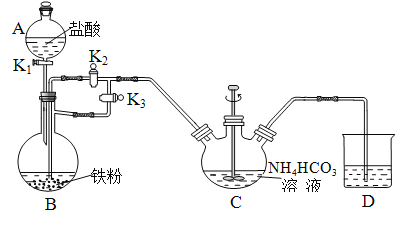
题目内容
【题目】中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:

下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
【答案】C
【解析】
A选项,电极Ⅰ为正极,其反应为:O2 + 4H+ + 4e-=2H2O,故A错误;
B选项,根据图中信息右边酸性溶液,左边为碱性海水,右边氢离子不能通过聚丙烯半透膜,故B错误;
C选项,如果电极II为活性镁铝合金,镁铝形成很多细小的原电池,镁失去电子,铝上氢离子得到电子,因此在负极区会逸出大量气体,故C正确;
D选项,当不是标准状况下,无法算正极消耗气体的体积,故D错误。
综上所述,答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I![]() = H2O + IO
= H2O + IO![]() ;H2O2 + IO
;H2O2 + IO![]() = H2O + O2↑+ I
= H2O + O2↑+ I![]() 。总反应的化学方程式是_______________________________________________。
。总反应的化学方程式是_______________________________________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______(填字母)。
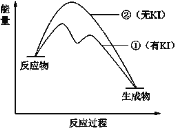
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I![]() = H2O + IO
= H2O + IO![]() 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________。
(4)资料4:I![]() + I
+ I![]()
![]() I
I![]() K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I | I | I |
浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
① a =____________________。
② 该平衡体系中除了含有I![]() 、I
、I![]() 和I
和I![]() 外,一定还含有其他含碘微粒,理由是_____________________。
外,一定还含有其他含碘微粒,理由是_____________________。