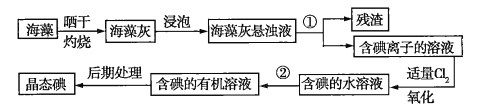
题目内容
【题目】可用于检测CO的某气敏传感器的工作原理如图所示。下列说法不正确的是

A.工作过程中化学能转化为电能
B.工作一段时间后溶液的pH几乎不变
C.电极I上发生反应:CO - 2e- + H2O = CO2 + 2H+
D.电极II上发生反应:O2 + 2H2O + 4e- = 4OH![]()
【答案】D
【解析】
该传感器在工作过程中,负极上CO失电子生成CO2,![]() ,则Ⅰ为负极,氧气在正极上得电子,Ⅱ为正极,
,则Ⅰ为负极,氧气在正极上得电子,Ⅱ为正极,![]() ,其电池的总反应为
,其电池的总反应为![]() 。
。
A. 装置属于原电池装置,工作过程中化学能转化为电能,故A正确;
B. 电池的总反应为![]() ,工作一段时间后溶液的pH几乎不变,故B正确;
,工作一段时间后溶液的pH几乎不变,故B正确;
C. 由图可知,CO在负极上失去电子生成二氧化碳,则通CO的电极反应式为![]() ,故C正确;
,故C正确;
D. 氧气在正极上得电子,Ⅱ为正极,酸性环境中电极反应式为:![]() ,故D错误;
,故D错误;
故选:D。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I![]() = H2O + IO
= H2O + IO![]() ;H2O2 + IO
;H2O2 + IO![]() = H2O + O2↑+ I
= H2O + O2↑+ I![]() 。总反应的化学方程式是_______________________________________________。
。总反应的化学方程式是_______________________________________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______(填字母)。
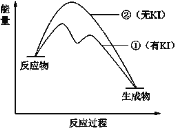
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I![]() = H2O + IO
= H2O + IO![]() 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________。
(4)资料4:I![]() + I
+ I![]()
![]() I
I![]() K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I | I | I |
浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
① a =____________________。
② 该平衡体系中除了含有I![]() 、I
、I![]() 和I
和I![]() 外,一定还含有其他含碘微粒,理由是_____________________。
外,一定还含有其他含碘微粒,理由是_____________________。