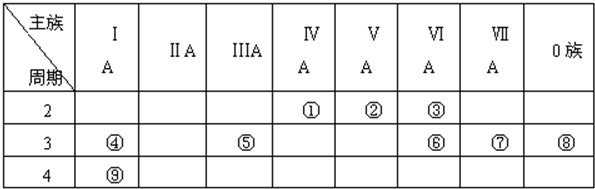
题目内容
5.已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | X与Y形成的化合物中必有离子键 | D. | 原子半径Z>Y |
分析 1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,
A.Y为O元素,Z为F元素,处于第二周期,W为Al元素,X为Na元素,处于第三周期,故A错误;
B.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HF>H2O,故B错误;
C.X与Y形成的化合物有氧化钠、过氧化钠,均含有离子键,故C正确;
D.同周期自左而右原子半径减小,故原子半径Z(F)<Y(O),故D错误,
故选C.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.

练习册系列答案
相关题目
16.一定量的锌粉和6mol•L-1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuCl2③铜粉 ④铁粉 ⑤浓盐酸 ⑥硝酸时,能够加快反应速率,又不影响产生H2总量的是( )
| A. | ②④⑤ | B. | ①②③⑤ | C. | ①③⑤ | D. | ①③⑤⑥ |
13.下列有关有机物结构说法不正确的是( )
| A. | 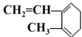 与Br2发生1:1加成反应的产物有5种 与Br2发生1:1加成反应的产物有5种 | |
| B. | 咖啡鞣酸 在酸性条件下水解,产物均为手性分子 在酸性条件下水解,产物均为手性分子 | |
| C. | 乙醛和丙烯醛(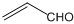 )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| D. |  分子中所有原子不可能在同一平面上 分子中所有原子不可能在同一平面上 |
20.松油醇结构如图所示,下列有关松油醇的叙述正确的是( )
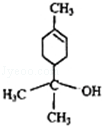

| A. | 松油醇的分子式为C10H20O | |
| B. | 松油醇分子在核磁共振氢谱中有7个吸收峰 | |
| C. | 它属于芳香醇 | |
| D. | 松油醇能发生消去反应、还原反应、氧化反应、酯化反应 |
14.下列叙述中正确的是( )
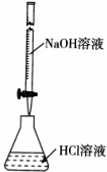

| A. | 根据图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 | |
| B. | 250℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中c(X+)一定大于c(A 3+ ) | |
| C. | 每个Fe(OH)3胶体粒子含一个氢氧化铁分子 | |
| D. | 某溶液中存在K+?HCO3-?CO32-?OH-?H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO2-3) |
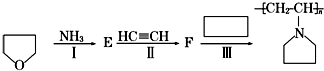
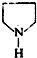 ,F
,F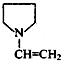
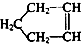 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: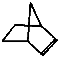
 .
.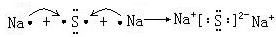 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.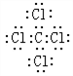 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.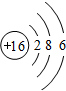 .
.